题目内容
下表是部分短周期元素的原子半径及主要化合价,以下叙述正确的是( )
| A.气态氢化物的稳定性为H2T<H2R |
| B.单质与稀盐酸反应的速率为L<Q |
| C.M与T形成的化合物具有两性 |
| D.L2+与R2-的核外电子数相等 |
C
解析

练习册系列答案
相关题目
日本大地震引发的福岛第一核电站核泄漏事故,造成放射性物质碘和铯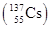 向外界泄漏。下列相关说法错误的是( )
向外界泄漏。下列相关说法错误的是( )
A.每个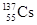 原子中有82个中子 原子中有82个中子 |
| B.CsOH的碱性比KOH强 |
| C.KIO3是碘的最高价氧化物的水化物的盐 |
| D.I-比F-还原性强 |
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍也是Y原子最外层电子数的3倍。下列说法正确的是( )
| A.Y与Z形成的简单离子核外电子排布相同 |
| B.X的氧化物为离子化合物 |
| C.Z的氢化物的水溶液在空气中容易变质 |
| D.X与Z对应的氧化物的水化物一定为强酸 |
下列说法错误的是( )
| A.原子最外层电子数为2的元素一定处于周期表ⅡA族 |
| B.主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5 |
| C.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 |
| D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
依据元素周期表及元素周期律,下列推断正确的是( )
| A.H3BO3的酸性比H2CO3的强 |
| B.Mg(OH)2的碱性比Be(OH)2的强 |
| C.HCl、HBr、HI的热稳定性依次增强 |
| D.若M+和R2-的核外电子层结构相同,则原子序数:R>M |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W |
| 原子半径/10-12 m | 160 | 110 | 70 | 66 |
| 主要化合价 | +2 | +5、+3、-3 | +5、+3、-3 | -2 |
下列叙述正确的是( )
A.离子半径:W2-<X2+
B.气态氢化物的稳定性:Z>W
C.化合物X3Z2中既含有离子键又含有共价键
D.最高价氧化物对应水化物的酸性:Z>Y
下列说法正确的是( )
| A.原子核外电子层数越多,原子半径越大 |
| B.每一主族所含非金属元素的种类可表示为︳族序数-2? |
C.根据泡利原理将氧元素基态原子的电子排布图书写为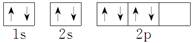 |
| D.C2H2分子中的碳采取sp2杂化 |
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
| | | R | |
| T | Q | | W |
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.含T的盐溶液一定显酸性