题目内容
【题目】(1)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
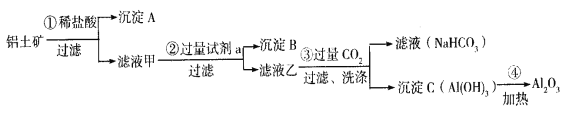
①沉淀 A、B的成分分别是____________、____________;步骤②中的试剂a是_________;(以上均填化学式)。
②试写出步骤③中发生反应的离子方式______________、________________;
③简述检验所得滤液甲中存在Fe3+的操作方法:________________________。
(2)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
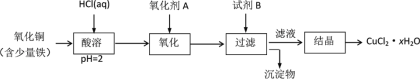
已知:在pH为4~5时,Fe3+几乎完全转化为Fe(OH)3沉淀,Cu2+却不反应。
①氧化剂最好选用__________(填编号)。
A.KMnO4 B.HNO3 C.Cl2
②写出“酸溶”时主要的离子方程式__________________________
③从滤液经过结晶得到氯化铜晶体的方法是_________(按实验先后顺序选填编号)。
A. 过滤 B. 蒸发至干 C. 冷却结晶 D. 蒸发浓缩
【答案】SiO2 Fe(OH)3 NaOH CO2 +OH- =HCO3- CO2 +AlO2- +2H2O=Al(OH)3 ↓+HCO3- 取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色,如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+ C CuO+2H+=Cu2++H2O DCA
【解析】
(1)①为盐酸,则在①得到的滤液甲中含有Al3+、Fe3+,沉淀A为二氧化硅;②为氢氧化钠溶液,除去Fe3+ ,将Al3+转化为AlO2-,在②得到的滤液乙中通入试剂③二氧化碳,将AlO2-转化为Al(OH )3沉淀,氢氧化铝加热分解得氧化铝。
(2)向固体中加入盐酸,盐酸和铁、氧化铜反应,发生的离子反应方程式为:Fe+2H+=Fe2++ H2↑;CuO+2H+=Cu2++ H2O,加入氧化剂A 的目的是把亚铁离子氧化,根据除杂原则,不能引入新的杂质;加入试剂B的目的是调节pH使铁离子生成氢氧化铁沉淀,过滤除去沉淀,对滤液进行蒸发浓缩、冷却结晶、过滤得到氯化铜晶体。
(1)①沉淀A是SiO2,沉淀B是Fe(OH )3,步骤②中的试剂a是NaOH溶液,故答案为:SiO2;Fe(OH)3;NaOH。
②滤液乙含有0H-、AlO2-,步骤③通入过量二氧化碳,与0H-反应生成碳酸氢根离子,与AlO2-反应生成的沉淀为氢氧化铝,离子方程式为: CO2 +OH- =HCO3-;CO2 +AlO2- +2H2O=Al(OH)3 ↓+HCO3-,故答案为:CO2 +OH- =HCO3-;CO2 +AlO2- +2H2O=Al(OH)3 ↓+HCO3-。
③通常用KSCN溶液检验Fe3+是否存在,取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色,如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+,故答案为:取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色,如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+。
(2)①根据题意,加入氧化剂X可把Fe2+氧化为Fe3+,而没有增加新杂质,所以A为Cl2,故选C。
②向固体中加入盐酸,盐酸和铁、氧化铜反应,发生的离子反应方程式为:Fe+2H+=Fe2++ H2↑;CuO+2H+=Cu2++ H2O,所以“酸溶”时主要的离子方程式:CuO+2H+=Cu2++ H2O,故答案为:CuO+2H+=Cu2++ H2O。
③从滤液经过结晶得到氯化铜晶体,首先要加热蒸发浓缩,冷却结晶后,再将之过滤即可,故答案为:DCA。