题目内容
(14分)(NH4)2Fe(SO4)2比FeSO4稳定,其标准溶液是定量实验中的常用试剂。
(1) 实验室用(NH4)2Fe(SO4)2固体配制一定浓度的(NH4)2Fe(SO4)2标准溶液。
①配制溶液时,需要使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的 (填字母代号)
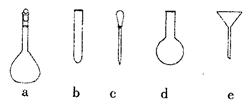
②若要配制0.100 mol·L-1的(NH4)2Fe(SO4)2标准溶液250ml,需称取(NH4)2Fe(SO4)2 g
③若在配制过程中,烧杯中的(NH4)2Fe(SO4)2溶液有少量溅出,则所得溶液浓度 ;若在定容时,俯视液面,则所得溶液浓度 。(填“偏高”、“偏低”、“无影响”)
(2)能电离出两种阳离子的盐称为复盐,下列物质中属于复盐的有 。
a.KAl(SO4)2 b.KAlO2 c.NH4Al(SO4)2 d.[Ag(NH3)2]NO3
(3)(NH4)2Fe(SO4)2溶液呈酸性,试用离子方程式解释其原因:
; 。
(1) 实验室用(NH4)2Fe(SO4)2固体配制一定浓度的(NH4)2Fe(SO4)2标准溶液。
①配制溶液时,需要使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的 (填字母代号)

②若要配制0.100 mol·L-1的(NH4)2Fe(SO4)2标准溶液250ml,需称取(NH4)2Fe(SO4)2 g
③若在配制过程中,烧杯中的(NH4)2Fe(SO4)2溶液有少量溅出,则所得溶液浓度 ;若在定容时,俯视液面,则所得溶液浓度 。(填“偏高”、“偏低”、“无影响”)
(2)能电离出两种阳离子的盐称为复盐,下列物质中属于复盐的有 。
a.KAl(SO4)2 b.KAlO2 c.NH4Al(SO4)2 d.[Ag(NH3)2]NO3
(3)(NH4)2Fe(SO4)2溶液呈酸性,试用离子方程式解释其原因:
; 。
(共12分)
(1) ①ac(2分) ②7.1g(2分) ③偏低;偏高(2分)
(2)ac(2分)
(3) NH4++H2O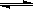 NH3·H2O+H+;Fe2++2H2O
NH3·H2O+H+;Fe2++2H2O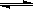 Fe(OH)2+2H+。(4分)
Fe(OH)2+2H+。(4分)
(1) ①ac(2分) ②7.1g(2分) ③偏低;偏高(2分)
(2)ac(2分)
(3) NH4++H2O
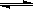 NH3·H2O+H+;Fe2++2H2O
NH3·H2O+H+;Fe2++2H2O Fe(OH)2+2H+。(4分)
Fe(OH)2+2H+。(4分)略

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 好的溶液倒入用蒸馏水洗净而末干的试剂瓶中备用
好的溶液倒入用蒸馏水洗净而末干的试剂瓶中备用 B偏低、C无影响)
B偏低、C无影响) 加入过
加入过 量的除杂质试剂。某校化学课外活动小组为了除去粗盐中含有少量Na2SO4、MgCl2,设计了下列实验步骤:
量的除杂质试剂。某校化学课外活动小组为了除去粗盐中含有少量Na2SO4、MgCl2,设计了下列实验步骤: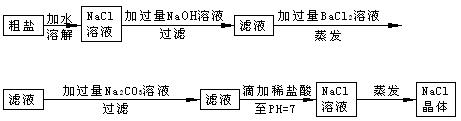
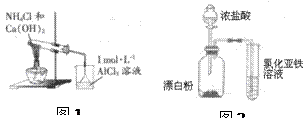
 量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;_________;_________。
量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;_________;_________。