题目内容
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是
| A.若M(甲)>M(乙),则气体体积:甲<乙 |
| B.若M(甲)<M(乙),则气体的压强:甲>乙 |
| C.若M(甲)>M(乙),则气体的摩尔体积:甲<乙 |
| D.若M(甲)<M(乙),则的分子数:甲<乙 |
B
解析试题分析:A、两个密闭容器中,分别充有等质量、等密度的甲、乙两种气体,根据ρ=m/v可知气体的体积相等,错误;B、若M(甲)<M(乙),根据n=m/M,则气体的物质的量:甲>乙,由PV=nRT可知,气体的压强:甲>乙,正确;C、若M(甲)>M(乙),则气体的物质的量:甲<乙,则气体的摩尔体积:甲>乙,错误;D、若M(甲)<M(乙),则n(甲)>n(乙),则气体的分子数:甲>乙,错误。
考点:考查阿伏加德罗定律的应用。

练习册系列答案
相关题目
| |||||||||||||||
下列说法不正确的是(NA表示阿佛加德罗常数):
| A.常温常压下,11.2升氯气含有的分子数为0.5NA |
| B.在常温常压下,1mol氮气含有的原子数为2NA |
| C.53g碳酸钠中含NA个Na+ |
| D.标准状况下,以任意比例混和的氢气和氧气混和物22.4升,所含的原子数为2NA |
NA表示阿伏加德罗常数的值,下列有关说法正确的是
| A.标准状况下,22.4 LCH4和CH3CH2OH的混合物所含分子数为NA |
| B.常温常压下,16 g14CH4所含中子数目为8 NA |
| C.0.2 mol的Na2O2和水完全反应转移的电子数为0.2 NA |
| D.0.1 L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
下列化学用语或模型正确的是 ( )
A.CH3Cl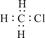 | B.乙烯的结构简式 CH2CH2 |
C.硝基苯的结构简式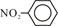 | D.CH4分子的比例模型 |
根据下列各题所给出的数据,得出的结论错误的是( )
| A.同温同压下,VLCO和H2的混合气体,完全燃烧消耗O2的体积为0.5VL |
| B.4.2g氮气和4.8g某单质RX所含原子个数相同,且分子个数之比为1:1,则R的相对原子质量为16 |
C.已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液中氢氧化钠的质量分数为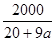 % % |
| D.将98g H2SO4溶于 1 L水中,则所制得的H2SO4溶液的物质的量浓度为1 mol/L |
某盐的混合物中含有0.2 mol/L Na+、0.4 mol/L Mg2+、0.4 mol/L Clˉ,则SO42ˉ为
| A.0.1 mol/L | B.0.2 mol/L | C.0.3 mol/L | D.0.4 mol/L |
V1ml、0.2 mol/L Na2SO4溶液和V2ml、0.1 mol/L Fe2(SO4)3溶液混合,已知V1大于V2 ,则混合溶液中SO42-的物质的量浓度可能是
| A.0.23 mol/L | B.0.18 mol/L | C.0.26 mol/L | D.0.25 mol/L 1 |
下列有关化学用语正确的是
| A.Fe的价层电子排布式为3d64s2 | B.35Br的电子排布式可简写为[Ar]4s24p5 |
C.NH4Cl的电子式为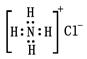 | D.氯离子结构示意图为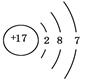 |