题目内容
【题目】往含Cl-和I-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示。下列说法正确的是
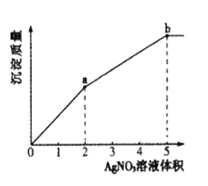
A.KSP (AgCl) < KSP (AgI)
B.c( Cl- ) :c( I-) =3:2
C.m( AgCl ) :m( AgI ) =" 2" :3
D.a~b段产生黄色沉淀
【答案】B
【解析】
氯化银相对分子质量小于碘化银,依据图象0-a、a-b段斜率可知,0-a生成的为碘化银,a-b段生成为氯化银,依据根据发生反应:I-+Ag+=AgI↓,Cl-+Ag+=AgCl↓判断原溶液中n(I-)、n(Cl-),依据消耗的硝酸银的体积判断生成m(AgCl):m(AgI),据此解答。
氯化银相对分子质量小于碘化银,依据图象0-a、a-b段斜率可知,0-a生成的为碘化银,a-b段生成为氯化银,
A.依据溶度积规则,可知向含Cl-和I-的稀溶液中滴入AgNO3溶液,先产生碘化银,说明碘化银溶解度小于氯化银,所以KSP(AgCl)>KSP(AgI),故A错误;
B.从图象可知,反应碘离子消耗硝酸银2体积,反应氯离子消耗硝酸银3体积,依据方程式:I-+Ag+=AgI↓,Cl-+Ag+=AgCl↓可知n(I-):n(Cl-),而氯离子、碘离子在同一溶液中,所以c(Cl-):c(I-)=3:2,故B正确;
C.从图象可知,反应碘离子消耗硝酸银2体积,反应氯离子消耗硝酸银3体积,依据方程式:I-+Ag+=AgI↓,Cl-+Ag+=AgCl↓可知n(I-):n(Cl-),所以生成碘化银和氯化银的物质的量之比为:n(AgCl):n(AgI)=3:2,m(AgCl):m(AgI)=3×143.5:2×162.5≠2:3,故C错误;
D.往含Cl-和I-的稀溶液中滴入AgNO3溶液,先发生I-+Ag+=AgI↓,0-a段,生成的碘化银为黄色沉淀,故D错误;
故选:B。

【题目】某实验小组用0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸进行中和热的测定,测定稀硫酸和稀氢氧化钠溶液反应的中和热的实验装置如图所示:

(1)仪器A的名称为___。
(2)装置中碎泡沫塑料的作用是___。
(3)写出表示该反应中和热的热化学方程式(中和热为57.3kJ·mol-1):___。
(4)取50mLNaOH溶液和30mL硫酸进行实验,实验数据如下表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | ||
1 | H2SO4 | NaOH | 平均值 | ||
1 | 26.6 | 26.6 | 26.6 | 29.1 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①温度差平均值为___℃。
②近似认为0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·(g·℃)-1。则中和热△H=-53.5kJ/mol。
③上述结果与57.3 kJ·mol-1有偏差,产生此偏差的原因可能是___(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度