题目内容
下列分子的中心原子的杂化类型与其他不同的是( )
| A、SiCl4 |
| B、H2S |
| C、PCl5 |
| D、NH3 |
考点:原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:根据分子的组成判断形成的δ键数目以及孤电子对数目,以此判断杂化类型.
解答:
解:A.SiCl4中C形成4个δ键,无孤电子对,为sp3杂化;
B.H2S中S形成2个δ键,孤电子对数=
(6-2×2)=2,则为sp3杂化;
C.PCl5中P形成5个δ键,没有孤电子对数,为sp3d杂化;
D.NH3中N形成3个δ键,孤电子对数=
(5-3×1)=1,为sp3杂化;
所以四种分子中中心原子杂化类型与三个不同的是PCl5.
故选C.
B.H2S中S形成2个δ键,孤电子对数=
| 1 |
| 2 |
C.PCl5中P形成5个δ键,没有孤电子对数,为sp3d杂化;
D.NH3中N形成3个δ键,孤电子对数=
| 1 |
| 2 |
所以四种分子中中心原子杂化类型与三个不同的是PCl5.
故选C.
点评:本题考查原子轨道的杂化类型的判断,题目难度不大,本题注意δ键数目以及孤电子对数目的判断,为解答该题的关键.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
下列说法中,正确的是( )
| A、周期表中的主族都有非金属元素 |
| B、周期表中的主族都有金属元素 |
| C、周期表中的非金属元素都位于短周期 |
| D、周期表中的过渡元素都是金属元素 |
把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池.A、B相连时,A为负极;C、D相连时,电流由D→导线→C;A、C相连时,A极减轻;B、D相连时,D极发生氧化反应.则四种金属的活动性顺序由大到小排列为( )
| A、A>B>C>D |
| B、A>C>B>D |
| C、A>C>D>B |
| D、B>D>C>A |
某电解池中盛有CuCl2溶液,插入电极进行电解,若达到下列要示:①一电极质量减轻,另一电极质量增加;②电解质的组成不变.则应选用的电极是( )
| A、阳极铜、阴极铜 |
| B、阳极石墨、阴极铜 |
| C、阳极铁、阴极铜 |
| D、阳极铜、阴极铁 |
在一定温度下,可逆反应4A(气)+5B(气)?4C(气)+6D(气)达到平衡的标志是( )
| A、单位时间内消耗n mol的A,同时生成n mol的C |
| B、单位时间内消耗n mol的A,同时生成n mol的B |
| C、A、B、C、D的分子数之比为4:5:4:6 |
| D、容器的总压强不随时间而变化 |
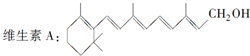 若将有机物分子中碳、氢元素符号省略,而只表示分子中键的连接情况,每个拐点或终点均表示一个碳原子,称为键线式,如丙烷的键线式为.人体对维生素的需要量虽少,但一旦缺乏,人体就不能正常发育,还会引起疾病,下面是维生素A的结构简式:
若将有机物分子中碳、氢元素符号省略,而只表示分子中键的连接情况,每个拐点或终点均表示一个碳原子,称为键线式,如丙烷的键线式为.人体对维生素的需要量虽少,但一旦缺乏,人体就不能正常发育,还会引起疾病,下面是维生素A的结构简式: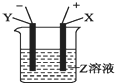 根据如图所示装置回答:
根据如图所示装置回答: