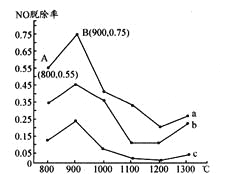
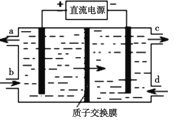
题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
B.反应 5NH4NO3![]() 2HNO3+4N2↑ +9H2O 中,生成 28 g N2 时,转移的电子数目为3.75 NA
2HNO3+4N2↑ +9H2O 中,生成 28 g N2 时,转移的电子数目为3.75 NA
C.0.1 mo1·L-1 MgCl2溶液中含Cl-数为0.2NA
D.3.9 g Na2O2 晶体中含有的离子总数为0.2NA
【答案】B
【解析】
A. 在氢氧化钠溶液中,氢氧根绝大多数来自氢氧化钠的电离,氢离子全部来自水的电离,而pH=13的NaOH溶液中,氢离子浓度为1013mol/L,故1L溶液中水电离出的氢离子的物质的量为1013mol,水电离出的氢氧根的物质的量也为1013mol,个数为1013NA,故A错误;
B.反应 5NH4NO3![]() 2HNO3+4N2↑ +9H2O 中,生成 28 g N2 时,转移的电子数目为3.75 mol ,故转移的电子数目为3.75 NA,故B正确;
2HNO3+4N2↑ +9H2O 中,生成 28 g N2 时,转移的电子数目为3.75 mol ,故转移的电子数目为3.75 NA,故B正确;
C. 溶液体积不明确,故溶液中的氯离子的个数无法计算,故C错误;
D.3.9g过氧化钠的物质的量为0.05mol,而过氧化钠中含2个钠离子和1个过氧根离子,故0.05mol过氧化钠中含有的离子个数为1.5NA个,故D错误。
答案选B。

【题目】在甲、乙、丙三个不同密闭容器中,按不同方式投料,起始浓度和起始容积相同,一定条件下发生反应:![]() 。相关数据如表所示:下列说法正确的是( )
。相关数据如表所示:下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料n |
|
|
|
平衡时容器体积 |
|
|
|
反应的平衡常数K |
|
|
|
平衡时 |
|
|
|
平衡时 |
|
|
|
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【题目】碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的基本原料.请根据题意回答下列问题:
Ⅰ![]() 世界最早工业生产碳酸钠的方法是路布兰
世界最早工业生产碳酸钠的方法是路布兰![]() 法.其流程如下:
法.其流程如下:

![]() 流程I的另一产物是 ______ ,流程Ⅱ的反应分步进行:
流程I的另一产物是 ______ ,流程Ⅱ的反应分步进行:![]()

![]() ;
;
![]() 与石灰石发生复分解反应,总反应方程式可表示为 ______ .
与石灰石发生复分解反应,总反应方程式可表示为 ______ .
Ⅱ![]() 年,比利时人索尔维
年,比利时人索尔维![]()
![]() 用氨碱法生产碳酸钠.反应原理如下:
用氨碱法生产碳酸钠.反应原理如下:

![]() 时一些物质在水中的溶解度
时一些物质在水中的溶解度![]()
NaCl |
|
|
|
|
|
|
|
|
|
![]() 氨碱法生成纯碱的原料是 ______ ,可循环利用的物质有 ______ .
氨碱法生成纯碱的原料是 ______ ,可循环利用的物质有 ______ .
![]() 饱和NaCl溶液通
饱和NaCl溶液通![]() 和
和![]() 能生成
能生成![]() 的原因有: ______ .
的原因有: ______ .
Ⅲ![]() 我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.

![]() 生产中需向分离出
生产中需向分离出![]() 后所得的溶液中加入NaCl固体并通入
后所得的溶液中加入NaCl固体并通入![]() ,在 ______
,在 ______ ![]() 填温度范围
填温度范围![]() 下析出 ______
下析出 ______ ![]() 填化学式
填化学式![]()