题目内容
【题目】将1.8g碳置于2.24L(标准状况)O2中充分燃烧,至全部反应物耗尽,测得放出热量30.65kJ,已知:C(s)+O2(g)=CO2(g)△H=﹣393.0kJmol-1综合上述信息,请写出CO完全燃烧的热化学方程式__________________________。
(2)光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)![]() COCl2(g)△H<0制备。如图1为某次模拟实验研究过程中容积为1L的密闭容器内各物质的浓度随时间变化的曲线(图中Cl2的起始浓度为1.2mol/L,CO的起始浓度为1.0mol/L)。回答下列问题:
COCl2(g)△H<0制备。如图1为某次模拟实验研究过程中容积为1L的密闭容器内各物质的浓度随时间变化的曲线(图中Cl2的起始浓度为1.2mol/L,CO的起始浓度为1.0mol/L)。回答下列问题:

①若保持温度不变,在第8min加入体系中的三种物质个1mol,则平衡____________移动(填“向反应正方向”、“向逆反应方向”或“不”);
②若将初始投料浓度变为c(Cl2)=0.8mol/L、c(CO)=0.6mol/L、c(COCl2)=____________mol/L,保持反应温度不变则最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同;
③比较第8秒反应温度T(8)与第15min反应温度T(15)的高低:T(8) T(15)(填“<”、“>”、或“=”)
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
①已知一定条件下,该反应中CO2的平衡转化率随温度、投料比 [![]() ]的变化曲线如图2:在其他条件不变时,请在图3中画出平衡时CH3OCH3的体积分数随投料比[
]的变化曲线如图2:在其他条件不变时,请在图3中画出平衡时CH3OCH3的体积分数随投料比[![]() ]变化的曲线图:
]变化的曲线图:

(4)常温下,将 a mol·L -1的醋酸 与 b mol·L -1 Ba(OH)2 溶液等体积混合,充分反应后,溶液中存在 2c(Ba 2+)=c(CH3COO-),则混合溶液中醋酸的电离常数 Ka=______________(含a和b的代数式表示)
【答案】(1)2CO(g)+O2(g)=2CO2(g)△H=﹣566kJmol﹣1。(2分)
(2)①向正反应方向(2分)②0.4(2分)③<(2分)
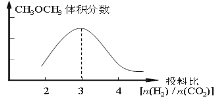
(3)① (0点开始1分,3这点最高1分)
(0点开始1分,3这点最高1分)
②CH3OCH3-12e-+16OH-=2CO32-+11H2O(2分)(4)![]() (2分)
(2分)
【解析】
试题分析:(1)1.8g碳的物质的量是1.8g÷12g/mol=0.15mol,2.24L(标准状况)O2的物质的量是0.1mol,二者充分燃烧,至全部反应物耗尽,设生成CO和CO2的物质的量分别是xmol和ymol,则x+y=0.15、x+2y=0.2,解得x=0.1,y=0.05。已知:C(s)+O2(g)![]() CO2 (g) △H=-393.0 kJ·mol—1,所以如果完全转化为二氧化碳放出的热量是0.15mol×393.0kJ/mol=58.95kJ。由于测得放出热量30.65 kJ,这说明生成0.1molCO继续燃烧可以放出的热量是58.95kJ-30.65kJ=28.3kJ,1molCO完全燃烧放出的热量是283kJ,则热化学方程式为2CO (g)+O2(g) =2CO2 (g) ΔH=-566kJ·mol-1。
CO2 (g) △H=-393.0 kJ·mol—1,所以如果完全转化为二氧化碳放出的热量是0.15mol×393.0kJ/mol=58.95kJ。由于测得放出热量30.65 kJ,这说明生成0.1molCO继续燃烧可以放出的热量是58.95kJ-30.65kJ=28.3kJ,1molCO完全燃烧放出的热量是283kJ,则热化学方程式为2CO (g)+O2(g) =2CO2 (g) ΔH=-566kJ·mol-1。
(2)①若保持温度不变,在第8 min 加入体系中的三种物质各1 mol,则相当于是增大压强,平衡向正反应方向移动;
②保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同,说明是等效平衡,则在温度和容积不变的条件下要满足投料比与最初的相同。设光气的浓度是xmol/L,则根据根据方程式可知相当于是起始物质的浓度为氯气:0.8+x,CO:0.6+x,所以有![]() ,解得x=0.4。
,解得x=0.4。
③根据图像可知第8min时反应物浓度大于第15min时反应物浓度,而生成物浓度小于第15min时反应物浓度,这说明平衡常数减小。由于正方应是放热反应,则改变的条件是升高温度,所以第8 min反应温度T(8)小于第15 min反应温度T(15)。
(3)由方程式可知,投料比为3时,两者的转化率相同,二甲醚的体积分数最大,因此平衡时CH3OCH3的体积分数随投料比[n(H2) / n(CO2)]变化的曲线图可表示为
②二甲醚酸性介质燃料电池的负极应该通入二甲醚,发生失去电子的氧化反应,则电极反应式为CH3OCH3-12e-+3H2O=2CO2↑+12H+。
(4)反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,据电荷守恒,溶液中c(H+)=c(OH-)=10-7mol/L,溶液中醋酸的浓度是(0.5a-b)mol/L,则醋酸电离平衡常数K=![]() =
=![]() ×10-7。
×10-7。

 名校课堂系列答案
名校课堂系列答案