题目内容
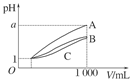
某温度下,向一定物质的量浓度的盐酸和醋酸中分别加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。根据图判断下列说法正确的是( )


| A.曲线Ⅱ为醋酸稀释时的变化曲线 |
| B.a、b、c三点溶液的pH大小顺序为a>b>c |
| C.a点的Kw值比b点的Kw值大 |
| D.b点水电离的H+物质的量浓度小于c点水电离的H+物质的量浓度 |
D
A 错误,曲线Ⅱ为盐酸稀释时的变化曲线,因为盐酸是强酸,全部电离,加水稀释,没有缓冲能力,比醋酸中氢离子浓度降低的快,导电能力减小的快。
B 错误,离子浓度越小时,导电能力就越弱,PH值就越大,即c>b>a
C 错误,温度不变,Kw值也不变。
D 正确,b点酸性比c点酸性强,对水电离的抑制作用就强,所以,b点水的电离程度要弱于c点。
B 错误,离子浓度越小时,导电能力就越弱,PH值就越大,即c>b>a
C 错误,温度不变,Kw值也不变。
D 正确,b点酸性比c点酸性强,对水电离的抑制作用就强,所以,b点水的电离程度要弱于c点。

练习册系列答案
相关题目

 H3O+ + CO32-
H3O+ + CO32-