题目内容
实验室以废铁屑为原料制备草酸亚铁晶体(FeC2O4·xH2O)。过程如下:

已知:①pH>4时,Fe2+易被氧气氧化;
②相关物质的溶解度曲线如图。
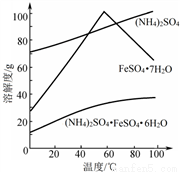
(1)①废铁屑在进行“溶解”前,需要在5%的Na2CO3 溶液中加热数分钟,并洗涤干净,Na2CO3溶液的作用是____________。
②用稀硫酸调溶液pH至1~2的目的:一是抑制Fe2+ 和NH4+的水解;二是 ________。
③操作I是为了得到(NH4)2SO4·FeSO4·6H2O,则操作I应进行蒸发浓缩、结晶、过滤。那么过滤时适宜的温度为__________。
④检验FeC2O4·xH2O沉淀是否洗涤干净的方法是____________。
(2)通常用已知浓度的酸性高锰酸钾溶液测定草酸亚铁晶体的纯度。已知酸性条件下MnO4-转化为Mn2+,写出MnO4-与Fe2+反应的离子方程式:____________。
(3)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备较纯净的FeSO4溶液,再合成FeC2O4·xH2O。请补充完整由硫铁矿烧渣制备纯净FeSO4溶液的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量硫铁矿烧渣中加入足量的稀硫酸充分反应,过滤,____________,过滤,得到较纯净的FeSO4溶液。
练习册系列答案
相关题目


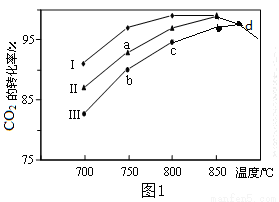
 CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。

 C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图2所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图2所示: 的分子式为C13H9O4N2
的分子式为C13H9O4N2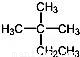 的系统命名为2﹣甲基﹣2﹣乙基丙烷
的系统命名为2﹣甲基﹣2﹣乙基丙烷 bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。
bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。
 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac