题目内容
(1)根据上述信息,推测摩擦剂应具备的性质有
①易溶于水 ②难溶于水 ③坚硬 ④柔软 ⑤颗粒较大 ⑥颗粒较小
(2)已知A品牌牙膏中的摩擦剂是Al(OH)3,取适量牙膏样品,加水成分搅拌、过滤.
①往滤渣中加入过量NaOH溶液,过滤,Al(OH)3与NaOH溶液反应的离子方程式是
②往①所得滤液中先通入过量CO2,再加入过量稀盐酸,观察到的现象是
(3)已知B品牌牙膏中的可能含有一种或两种物质,将此牙膏中的摩擦剂溶于盐酸时,发现有不溶性物质,
①对B品牌牙膏摩擦剂的成分提出合理假设:
假设1:牙膏摩擦剂的成分为SiO2
假设2:牙膏摩擦剂的成分为SiO2和CaCO3
假设3:牙膏摩擦剂的成分为
②设计方案对B品牌牙膏摩擦剂的成分进行实验,验证假设.请写出实验步骤以及预期现象和结论(可不填满).
限选试剂:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量牙膏样品,加水成分搅拌、过滤,得滤液A和沉淀B. | / |
| 步骤2: |
|
| 步骤3: |
(2)①Al(OH)3是两性氢氧化物和NaOH溶液反应生成偏铝酸钠和水;
②偏铝酸钠溶液中通入过量盐酸显生成氢氧化铝沉淀,氢氧化铝沉淀会溶解在盐酸中;
(3)①牙膏摩擦剂的主要成分有CaCO3、Al(OH)3、SiO2,根据由上边物质中的两种组成,进行两种物质的组合考虑;
②依据碳酸钙和氢氧化铝的性质分析设计实验,证明含有碳酸钙和氢氧化铝的实验方案和反应现象分析判断;
(4)依据碳酸钙和盐酸反应后剩余的盐酸被氢氧化钠溶液滴定测定剩余盐酸溶质物质的量,注意溶液体积变化,依据化学方程式计算碳酸钙物质的量得到质量计算碳酸钙的质量分数;
故答案为:②③⑥;
(2)①Al(OH)3是两性氢氧化物和NaOH溶液反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
②偏铝酸钠溶液中通入过量盐酸,先生成氢氧化铝沉淀,然后氢氧化铝沉淀会溶解在盐酸中,反应的离子方程式为:AlO2-+H++H2O=Al(OH)3↓,Al(OH)3+3H+=Al3++3H2O;
故答案为:通入CO2气体有白色沉淀生成;加入盐酸有气体生成、沉淀溶解;
(3)①牙膏摩擦剂的主要成分有CaCO3、Al(OH)3、SiO2,根据由上边物质中的两种组成,假设1:摩擦剂的成分为SiO2;假设2:摩擦剂的成分为SiO2和CaCO3;所以还缺少SiO2和Al(OH)3;的组合;所以假设3是SiO2和Al(OH)3;
故答案为:二氧化硅和氢氧化铝;
②设计方案对B品牌牙膏摩擦剂的成分进行实验,验证假设,取适量牙膏样品,加水成分搅拌、过滤,得滤液A和沉淀B,取适量沉淀B于试管中,滴加过量稀盐酸,出现无色气泡,说明含有碳酸钙;取步骤2的上层清液,滴加氢氧化钠溶液,溶液先生成沉淀,后沉淀溶解说明含有氢氧化铝;
故答案为:
| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2:取适量沉淀B于试管中,滴加过量稀盐酸. | 出现无色气泡,说明含有碳酸钙 |
| 步骤3:取步骤2的上层清液,滴加氢氧化钠溶液 | 溶液先生成沉淀,后沉淀溶解说明含有氢氧化铝. |
| 0.0375mol×100g/mol |
| 20.0g |
故答案为:0.075,18.75%;

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案下图是牙膏中某些主要成分检验流程图,请回答以下问题:
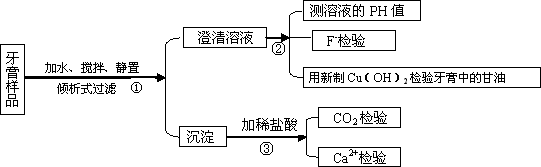
(1)牙膏中的摩擦剂约占牙膏成分的50%,主要用于增强牙膏的摩擦作用和去污效果,不同种类的牙膏含有的摩擦剂有所不同,在上述流程图的第③步加入盐酸后会产生不同现象,请你填空:
摩擦剂 | 实验中出现的现象 | 解 释 |
SiO2 |
|
|
CaCO3 |
|
|
Ca3(PO4)2 | 溶解无气体,加NaOH至过量后又产生沉淀 |
|
Al(OH)3 | 溶解无气体,加NaOH至过量先产生沉淀后溶解 |
|
(2)日常生活中使用的牙膏里面都含有一定量的摩擦剂,试回答下列相关问题:
A.根据你的推测,摩擦剂应具备下列性质中的哪几条?
① 易溶于水 ②难溶于水 ③坚硬 ④柔软 ⑤颗粒较大 ⑥颗粒较小
B.据调查,两面针儿童牙膏、珍珠王防臭牙膏和中华透明牙膏中所使用的摩擦剂依次是氢氧化铝、碳酸钙和二氧化硅,它们所属的物质类别依次是 、 、 。
C.作牙膏摩擦剂的粉末状碳酸钙可以用石灰石来制备。以下是一种制备碳酸钙的生产方案,其流程图为,请你写出上述方案中有关反应的化学方程式: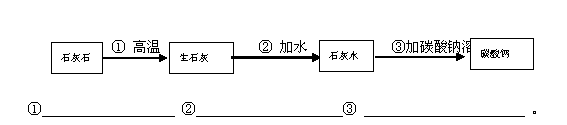
(3)新制Cu(OH)2的配制方法是 。
牙膏中含有一定量的甘油,其主要功能是作保湿剂,在流程图的第②步得到的澄清溶液中加入新制Cu(OH)2,产生的现象是 ,化学方程式为
(4)实验测定澄清溶液的PH>7,可能原因是 。
(5)牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
Ca5(PO4)3OH(固) 5Ca2++3PO43-+OH-
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是
已知Ca5(PO4)3F(固)的溶解度比上面的矿化产物更小,质地更坚固。主动脉用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因:
根据以上原理,请你提出一种其它促进矿化的方法:
下列关于牙膏的说法中不正确的是
| A.牙膏中加甘油作保湿剂,可用新制Cu(OH)2检验其存在 |
| B.牙膏中的摩擦剂可增强牙膏的摩擦作用和去污效果。 |
| C.牙膏中的增香剂和甜味剂可改善牙膏的口感 |
| D.用含氟牙膏刷牙可使牙齿坚固,从而有效防止蛀牙,故牙膏中的氟含量越高越好 |