题目内容
由Zn、Fe、Al、Mg四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标况下为11.2升,则混合物中一定含有的金属是
- A.Zn
- B.Al
- C.Fe
- D.Mg
B
分析:计算出氢气的质量,根据氢气的质量计算出各自反应时所需金属的质量,两种金属组成的混合物产生氢气11.2升时所需质量10g,应介于两金属分别于盐酸反应生成11.2升氢气时消耗金属量的之间.
解答:在标况下氢气的物质的量为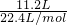 =0.5mol,
=0.5mol,
Zn~H2
65g 1mol
32.5g 0.5mol
所以生成氢气11.2升,需要Zn的质量为32.5g.
2Al~3H2
54g 3mol
9g 0.5mol
所以生成氢气11.2升,需要Al的质量为9g.
Fe~H2
56g 1mol
28g 0.5mol
所以生成氢气11.2升,需要Fe的质量为28g.
Mg~H2
24g 1mol
12g 0.5mol
所以生成氢气11.2升,需要Mg的质量为12.
两种金属组成的混合物产生氢气11.2升时所需质量10g,应介于两金属分别于盐酸反应生成11.2升氢气时消耗金属量的之间.只有Al的质量小于10g,所以混合物中一定含有Al.
故选B.
点评:本题考查混合物的有关计算,难度中等,本题采取极值法解答,从而简化计算.注意若有不反应的金属应视作需金属质量无穷大.
分析:计算出氢气的质量,根据氢气的质量计算出各自反应时所需金属的质量,两种金属组成的混合物产生氢气11.2升时所需质量10g,应介于两金属分别于盐酸反应生成11.2升氢气时消耗金属量的之间.
解答:在标况下氢气的物质的量为
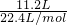 =0.5mol,
=0.5mol,Zn~H2
65g 1mol
32.5g 0.5mol
所以生成氢气11.2升,需要Zn的质量为32.5g.
2Al~3H2
54g 3mol
9g 0.5mol
所以生成氢气11.2升,需要Al的质量为9g.
Fe~H2
56g 1mol
28g 0.5mol
所以生成氢气11.2升,需要Fe的质量为28g.
Mg~H2
24g 1mol
12g 0.5mol
所以生成氢气11.2升,需要Mg的质量为12.
两种金属组成的混合物产生氢气11.2升时所需质量10g,应介于两金属分别于盐酸反应生成11.2升氢气时消耗金属量的之间.只有Al的质量小于10g,所以混合物中一定含有Al.
故选B.
点评:本题考查混合物的有关计算,难度中等,本题采取极值法解答,从而简化计算.注意若有不反应的金属应视作需金属质量无穷大.

练习册系列答案
相关题目