题目内容
实验室中迅速制备少量氯气可利用如下反应:
2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
此反应在常温下就可以迅速进行,而且对盐酸浓度要求不高。
(1)已知高锰酸钾和氯化锰都属于可溶性盐,请把上述化学方程式改写为离子方程式:________________________________________________________________________。
(2)该反应中,氧化剂是________,还原剂是________。当有1 mol氧化剂参加反应时,被氧化的还原剂的物质的量是________,产生的氯气在标准状况下的体积约为________。
(3)HCl在此反应过程中表现出的化学性质有________。
A.酸性 B.还原性
C.氧化性 D.挥发性
失去10×e-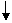



 解析: 2KMnO4+16HCl===2KCl+2M nCl2+5Cl 2↑+8H2O
解析: 2KMnO4+16HCl===2KCl+2M nCl2+5Cl 2↑+8H2O
 |
得到5e-×2
由方程式可知,氧化剂为KMnO4,还原剂为HCl,且2 mol氧化剂KMnO4氧化10 mol HCl,即1 mol KMnO4氧化5 mol HCl。
答案: (1)2MnO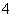 +16H++10Cl-===2Mn2++5Cl2↑+8H2O (2)KMnO4 HCl 5 mol 56 L (3)AB
+16H++10Cl-===2Mn2++5Cl2↑+8H2O (2)KMnO4 HCl 5 mol 56 L (3)AB

练习册系列答案
相关题目
 →I2
→I2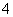 →Mn2+ HNO2→NO
→Mn2+ HNO2→NO Cd(OH)2 + 2Ni(OH)2有关其说法正确的是( )
Cd(OH)2 + 2Ni(OH)2有关其说法正确的是( )