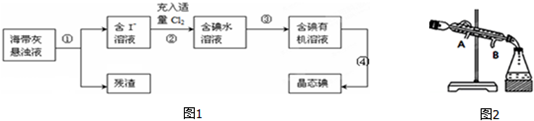
题目内容
11.下列与金属腐蚀有关的说法正确的是( )
| A. | 图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 图2中,一段时间后会出现白色沉淀-灰绿色沉淀-红褐色沉淀的现象 | |
| C. | 图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
分析 A、铁的吸氧腐蚀中,氧气的浓度越大,其腐蚀速率越快;
B、在酸性环境下,铁发生析氢腐蚀;
C、温度越高,铁越容易被氧化;
D、牺牲阳极的阴极保护法中,作负极的金属易被腐蚀
解答 解:A、铁的吸氧腐蚀中,氧气的浓度越大,其腐蚀速率越快,插入海水中的铁棒,越靠近底端氧气的浓度越小,则腐蚀越轻,故A错误;
B、在酸性环境下,铁发生析氢腐蚀,故不会生成氢氧化亚铁沉淀,故B错误;
C、温度越高,铁越容易被氧化,所以铁越容易生锈,故C正确;
D、用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁作负极而易被腐蚀,铁作正极被保护,故D错误;
故选C.
点评 本题考查金属的腐蚀与防护,明确原电池原理即可解答,知道铁离子和亚铁离子的检验方法,会描述现象,难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
1.下列离子方程式书写正确的是( )
| A. | C12与水反应C12+H2O═2H++C1-+ClO- | |
| B. | 氯化铁溶液与铁单质反应 Fe3++2Fe═3Fe2+ | |
| C. | 大理石与盐酸反应CO32-+2H+═H2O+CO2↑ | |
| D. | 二氧化硅与氢氧化钠溶液反应 SiO2+2OH-═SiO32-+H2O |
2.将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H20.125mol,原混合物的质量可能是( )
| A. | 2g | B. | 4g | C. | 8g | D. | 10g |
19.使用下列仪器进行加热操作时,必须垫石棉网的是( )
| A. | 试管 | B. | 烧瓶 | C. | 锥形瓶 | D. | 蒸发皿 |
6.如图为一张已部分缺损的体检报告单,其中表示第14项高密度脂蛋白胆固醇的物理量是( )

| A. | 质量分数 | B. | 物质的量 | C. | 摩尔质量 | D. | 物质的量浓度 |
3.在催化剂、400℃时可实现氯的循环利用,如图是其能量关系图,下列分析正确的是( )
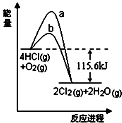

| A. | 曲线a是使用了催化剂的能量变化曲线 | |
| B. | 反应物的总键能高于生成物的总键能 | |
| C. | 反应的热化学方程式为:4HCl(g)+O2(g)$→_{400℃}^{催化剂}$2Cl2+2H2O(g)△H=+115.6 kJ/mol | |
| D. | 若反应生成2 mol 液态水,放出的热量高于115.6 kJ |
20.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105 Pa,32gO2所含原子数为NA | |
| C. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| D. | 在常温常压下,44gCO2含有的分子数为NA |