题目内容
19.下列实验方案的设计与评价合理的是( )| A. | B. | C. | D. |
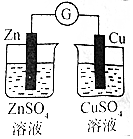 |  |  |  |
| 验证化学能转化为电能 | 验证氧化性:Cl2>Br2>I2 | 验证温度对平衡移动的影响 | 制取MgCl2固体 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.该装置没有形成闭合回路,无法构成原电池;
B.氯气能够氧化碘化钾,干扰了检验结果;
C.根据混合气体的颜色变化可验证温度对化学平衡的影响;
D.HCl易挥发,最终得到的是氧化镁固体.
解答 解:A.装置中缺少盐桥,没有形成闭合回路,无法验证化学能转化为电能,故A错误;
B.剩余的Cl2能够氧化KI,干扰了溴单质与碘化钾的反应,无法达到实验目的,故B错误;
C.升高温度平衡向生成NO2的方向移动,气体颜色加深,可验证温度对平衡移动的影响,故B正确;
D.镁离子水解生成氢氧化镁和HCl,氯化氢易挥发,加热灼烧后最终得到MgO,应该在HCl气流中加热,故D错误;
故选C.
点评 本题考查化学实验方案的评价,题目难度中等,涉及化学平衡及其影响、氧化还原反应、盐的水解原理应用等知识,明确化学平衡及其影响为解答关键,试题有利于提高学生的分析能力及化学实验能力.

练习册系列答案
相关题目
4.影响化学反应速率因素有很多,以下肯定能使化学反应速率加快的方法是( )
①升高温度
②通入N2
③增大反应物浓度
④将块状固体反应物磨成粉末
⑤增大压强.
①升高温度
②通入N2
③增大反应物浓度
④将块状固体反应物磨成粉末
⑤增大压强.
| A. | ①②③⑤ | B. | ①②④⑤ | C. | ①③④ | D. | ①②③④ |
11.已知4种短周期元素的离子W3+、X+、Y2-、Z-具有相同的电子层结构,下列判断中正确的是( )
| A. | 原子序数:X>W>Y>Z | B. | 原子半径:W>X>Z>Y | ||
| C. | 氧化性:X+>W3+ | D. | 氢化物稳定性:HZ>H2Y |
7.下列实验装置正确且能达到实验目的是( )
| A. |  提取海带中的碘 | B. |  检验火柴燃烧产生的SO2 | ||
| C. |  测定一定时间内生成H2的反应速率 | D. |  证明非金属性Cl>C>Si |
6.下列物质不能使酸性高锰酸钾溶液褪色的是( )
| A. | 苯乙烯 | B. | 花生油 | C. | 乙烷 | D. | 乙烯 |
 如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液.回答下列问题:
如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液.回答下列问题: +3Br2→
+3Br2→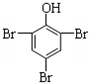 ↓+3HBr;反应类型取代反应.
↓+3HBr;反应类型取代反应. ;反应类型取代反应.
;反应类型取代反应. ;反应类型加聚反应.
;反应类型加聚反应.