题目内容
电解1mol/L CuSO4和0.1mol/L Cu(NO3)2的混合液100mL,当阳极析出896mL(标准状况)气体时,切断电源,使电极仍浸在溶液中,经充分反应后,阴极比原来增重多少克?溶液的pH是多少?(lg2=0.3)
【答案】
0.1
【解析】
试题分析:根据离子的放电顺序可知
阳极:4OH- -4e-=O2↑+ 2H2O
阴极:2Cu2++4e- = 2Cu
原溶液中n(Cu2+)=1mol/L×0.1L+0.1 mol/L×0.1L=0.11mol
电解中共生成氧气n(O2)=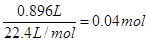
根据电荷守恒可知
2Cu2+~O2~4OH- ~ 4H+
2mol 1mol 4mol
x 0.04mol y
解得x=0.08mol、y=0.16mol
铜与稀硝酸反应多的方程式是
3Cu + 2 NO3-+ 8H+=3Cu2+ + 2NO + 4H2O
3mol 2mol 8mol
a 0.02mol b
解得a=0.03mol、b=0.08mol
即NO3-对于Cu及H+均不足量
所以阴极增重(即阴极上剩余Cu)∶(0.08mol-0.03mol)×64g/mol=3.2g
溶液中c(H+)=(0.16mol-0.08mol)÷0.1L=0.8mol/L
所以pH=-lg0.8=-lg8+1=-3lg2+1=0.1
考点:考查电解的有关判断和计算
点评:本题难度较大,对学生的要求较高。主要是有利于培养学生严谨的思维方式以及分析、总结、推理能力,也有利于培养学生的规范答题能力,提高学习兴趣。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目