题目内容
配平下列化学方程式:

解:该反应中元素的化合价变化如下:(NH4)2PtCl6 →Pt,Pt元素的化合价由+4价→0价,一个(NH4)2PtCl6 分子得4个电子;
(NH4)2PtCl6 →N2,N元素的化合价由-3价→0价,生成一个N2分子需失去6个电子,所以得失电子的最小公倍数为12,所以 Pt的计量数为3,N2的计量数为2;其它元素根据原子守恒配平即可,所以该方程式为:3 (NH4)2PtCl6=3Pt+2NH4Cl+16HCl+2N2.
故答案为:3;3;2;16;2.
分析:根据氧化还原反应中得失电子数相等配平.
点评:本题考查了氧化还原反应方程式的配平,根据氧化还原反应中得失电子数相等配平即可;该反应中氧化剂、还原剂是同一种物质,所以从生成物开始配平更容易些.
(NH4)2PtCl6 →N2,N元素的化合价由-3价→0价,生成一个N2分子需失去6个电子,所以得失电子的最小公倍数为12,所以 Pt的计量数为3,N2的计量数为2;其它元素根据原子守恒配平即可,所以该方程式为:3 (NH4)2PtCl6=3Pt+2NH4Cl+16HCl+2N2.
故答案为:3;3;2;16;2.
分析:根据氧化还原反应中得失电子数相等配平.
点评:本题考查了氧化还原反应方程式的配平,根据氧化还原反应中得失电子数相等配平即可;该反应中氧化剂、还原剂是同一种物质,所以从生成物开始配平更容易些.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目


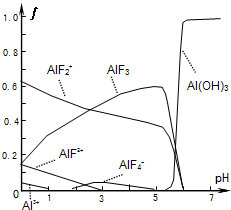 (2011?深圳一模)氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.
(2011?深圳一模)氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.