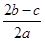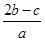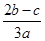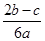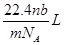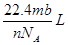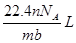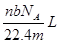题目内容
设NA为阿伏加德罗常数的值,下列叙述不正确的( )
| A.5g质量分数为46%的乙醇溶液中,氢原子的总数为0.6NA |
| B.5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2NA |
| C.50 mL 12 mol?L-1浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA |
| D.常温常压下,46g NO2 与N2O4的混合气体中含有的原子总数为3NA |
C
解析试题分析:解此类题要注意1、理清一套运算关系:n=N/NA=m/M=V/Vm=cV(aq)2、注意相关概念的理解3、注意审题细节①微粒种类②气体摩尔体积适用条件③物质的组成和结构④物质间的反应及特点⑤电离、水解和氧化还原反应。A、5g质量分数为46%的C2H5OH溶液中,C2H5OH的质量为2.3g,物质的量为0.05mol,氢原子的物质的量为0.3mol,H2O的质量为2.7g,物质的量为0.15mol,氢原子的物质的量为0.3mol,氢原子的总数为0.6NA,正确;B、5.6 g铁与0.1 mol氯气充分反应生成氯化铁,铁过量,根据氯气计算转移电子数为 0.2NA,正确;C、浓盐酸与足量二氧化锰加热反应,随着反应的进行盐酸的浓度逐渐变稀,稀盐酸与二氧化锰不反应,转移电子数小于0.3 NA,错误;D、NO2 与N2O4的最简式均为NO2,,46g NO2 的物质的量为1mol,含有的原子总数为3NA,正确。
考点:考查阿伏加德罗常数及相关计算。

练习册系列答案
相关题目
下列说法正确的是
| A.2.24 L CO2中含有的原子数为0.3×6.02×1023 |
| B.1.8 g NH4+ 含有的质子数为6.02×1023 |
| C.30 g乙酸和甲酸甲酯的混合物中含有的共价键数为4×6.02×1023 |
| D.7.8 g Na2O2中含有的阴离子数为0.2×6.02×1023 |
设NA为阿伏伽德罗常数的值。下列说法正确的是
| A.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA |
| B.常温下,10LpH=13的NaOH溶液中含有的OH-离子数为NA |
| C.标准状况下,11.2L己烷中含有分子的数目为0.5NA |
| D.100mL0.1mol·L-1的FeCl3溶液中含有Fe3+的个数为0.01 NA |
下列能表示阿伏加德罗常数数值的是
| A.1molH2含有的电子数 | B.通常状况下,22.4LCO2所含的分子数 |
| C.0.012kg12C所含的原子数 | D.1LO.5mol·L-1的CaCl2溶液所含的Cl-数 |
设NA表示阿伏伽德罗常数的数值,下列说法中正确的是
| A.0.5mol?L-1 Fe2(SO4)3溶液中含有SO42-数为1.5NA |
| B.7.8g Na2O2溶于水后,所得溶液中含有O22-数为NA |
| C.标准状况下,22.4LCl2与足量的铁粉反应,转移的电子数为3NA |
| D.常温常压下,7.0g乙烯和丙烯的混合物中含有氢原子的数目为NA |
设NA为阿伏加德罗常数。下列说法正确的是
| A.1L 1mol·L-1的NaClO 溶液中含有ClO-的数目为NA |
| B.1mol Mg在空气中燃烧被完全氧化生成MgO和Mg3N2,失去2 NA个电子 |
| C.标准状况下,22.4L苯含有1 NA个苯分子 |
| D.1mol的羟基与1mol的氢氧根离子所含电子数均为9 NA |
38.4mg Cu跟适量的浓HNO3反应,Cu全部作用后,在标准状况下收集到22.4mL(不考虑NO2部分聚合成N2O4),则消耗HNO3的物质的量( )
| A.1.0×10—3mol | B.1.6×10-3mol | C.2.2×10—3mol | D.2.4×10—3mol |
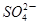 完全沉淀;向另一等份加入足量NaOH固体并加热可得到c mol NH3,则原溶液中Fe3+的物质的量浓度为( )mol·L-1
完全沉淀;向另一等份加入足量NaOH固体并加热可得到c mol NH3,则原溶液中Fe3+的物质的量浓度为( )mol·L-1