题目内容
下列叙述正确的是( )A.因CuS比Cu(OH)2更难溶,所以存在:CuS(s)+2OH-(aq)=Cu(OH)2(s)+S2-(aq)
B.室温下,稀NaOH溶液与稀CH3COOH溶液混合,所得溶液pH=7:c(CH3COO-)=c(Na+)
C.等体积、等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合:2HCO
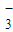 +Ba2++2OH-=BaCO3↓+2H2O
+Ba2++2OH-=BaCO3↓+2H2OD.用惰性电极电解CuSO4溶液:2Cu2++2H2O
 2Cu+2H2↑+O2↑
2Cu+2H2↑+O2↑
【答案】分析:离子方程式是指用实际参加反应的离子符号表示离子反应的式子.离子方程式的书写步骤一般为:
①“写”:写出有关反应的化学方程式;②“拆”:可溶性的电解质用离子符号表示,其它难溶的物质、气体、水等仍用化学式表示;③“删”:删去方程式两边不参加反应的离子; ④“查”:检查式子两边的各种原子的个数及电荷数是否相等;
A.硫化铜的溶解度小于氢氧化铜;
B.稀NaOH溶液和稀CH3COOH溶液混合,pH=7,溶液显示中性,根据电荷守恒来解答;
C.等体积物质的量浓度的NaHCO3和Ba(OH)2两溶液混合生成BaCO3和H2O,根据两者的物质的量解答;
D.以惰性电极电解CuSO4溶液,在阳极上氢氧根离子放电生成氧气,阴极上铜离子得到电子析出金属铜.
解答:解:A.氢氧化铜的溶解度大于硫化铜,向Cu(OH)2悬浊液中滴加Na2S溶液,发生Cu(OH)2(s)+S2-?CuS(s)+2OH--,故A错误;
B.稀NaOH溶液和稀CH3COOH溶液混合,pH=7,溶液显示中性,c(H+)=c(OH-),根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以c(CH3COO-)=c(Na+),故B正确;
C.等体积物质的量浓度的NaHCO3和Ba(OH)2两溶液,也就是NaHCO3和Ba(OH)2等物质的量,反应的离子方程式为HCO3-+Ba2++OH-=BaCO3↓+H2O,故C错误;
D.以惰性电极电解CuSO4溶液,在阳极上氢氧根离子放电生成氧气,阳极电极反应:4OH--4e-=2H2O+O2↑,阴极上铜离子得到电子析出金属铜,阴极电极反应:2Cu2++4e-=2Cu,总反应为:2Cu2++2H2O 2Cu↓+O2↑+4H+,故D错误;
2Cu↓+O2↑+4H+,故D错误;
故选B.
点评:本题考查离子方程式的书写,明确发生的反应并熟悉离子反应方程式的书写方法是解答本题的关键,题目难度不大.
①“写”:写出有关反应的化学方程式;②“拆”:可溶性的电解质用离子符号表示,其它难溶的物质、气体、水等仍用化学式表示;③“删”:删去方程式两边不参加反应的离子; ④“查”:检查式子两边的各种原子的个数及电荷数是否相等;
A.硫化铜的溶解度小于氢氧化铜;
B.稀NaOH溶液和稀CH3COOH溶液混合,pH=7,溶液显示中性,根据电荷守恒来解答;
C.等体积物质的量浓度的NaHCO3和Ba(OH)2两溶液混合生成BaCO3和H2O,根据两者的物质的量解答;
D.以惰性电极电解CuSO4溶液,在阳极上氢氧根离子放电生成氧气,阴极上铜离子得到电子析出金属铜.
解答:解:A.氢氧化铜的溶解度大于硫化铜,向Cu(OH)2悬浊液中滴加Na2S溶液,发生Cu(OH)2(s)+S2-?CuS(s)+2OH--,故A错误;
B.稀NaOH溶液和稀CH3COOH溶液混合,pH=7,溶液显示中性,c(H+)=c(OH-),根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以c(CH3COO-)=c(Na+),故B正确;
C.等体积物质的量浓度的NaHCO3和Ba(OH)2两溶液,也就是NaHCO3和Ba(OH)2等物质的量,反应的离子方程式为HCO3-+Ba2++OH-=BaCO3↓+H2O,故C错误;
D.以惰性电极电解CuSO4溶液,在阳极上氢氧根离子放电生成氧气,阳极电极反应:4OH--4e-=2H2O+O2↑,阴极上铜离子得到电子析出金属铜,阴极电极反应:2Cu2++4e-=2Cu,总反应为:2Cu2++2H2O
 2Cu↓+O2↑+4H+,故D错误;
2Cu↓+O2↑+4H+,故D错误;故选B.
点评:本题考查离子方程式的书写,明确发生的反应并熟悉离子反应方程式的书写方法是解答本题的关键,题目难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目