题目内容
19.实验室制取乙烯时常会伴有许多副反应,在得到纯净干燥的乙烯气体时不需要下列哪种药品( )| A. | 浓硫酸 | B. | 氢氧化钠溶液 | ||
| C. | 溴的四氯化碳溶液 | D. | 澄清石灰水 |
分析 得到纯净干燥的乙烯气体时,发生CH3CH2OH $→_{△}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,浓硫酸具有脱水性,使乙醇可能碳化,C与浓硫酸反应生成二氧化硫、二氧化碳,需要除去乙醇、二氧化硫、二氧化碳吸收水,以此来解答.
解答 解:A.制备乙烯需要浓硫酸,故A不选;
B.浓硫酸具有脱水性,使乙醇可能碳化,C与浓硫酸反应生成二氧化硫、二氧化碳,需要NaOH溶液除杂,故B不选;
C.不检验乙烯的性质,则不需要溴的四氯化碳溶液,故C选;
D.浓硫酸具有脱水性,使乙醇可能碳化,C与浓硫酸反应生成二氧化硫、二氧化碳,可需要澄清石灰水,故D不选;
故选C.
点评 本题考查混合物的分离提纯,为高频考点,把握发生的反应、物质的性质、混合物分离提纯等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
9.等体积的下列溶液中,阳离子的总物质的量最大的是 ( )
| A. | 0.2mol•L-1的CuSO4溶液 | B. | 0.1mol•L-1的Na2CO3 | ||
| C. | 0.2mol•L-1的KCl | D. | 0.1mol•L-1的Na2SO4 |
10.对于某些离子的检验及结论一定正确的是( )
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| B. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| C. | 无色溶液焰色反应呈黄色,结论:试液是钠盐溶液 | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
7.已知:①2H2(g)+O2(g)═2H2O (g)△H=-483.6kJ•mol
②H+(aq)+OH-(aq)═H2O(1)△H=-57.3kJ•mol
下列说法中正确的是( )
②H+(aq)+OH-(aq)═H2O(1)△H=-57.3kJ•mol
下列说法中正确的是( )
| A. | 由①式可知H2的燃烧热为241.8kJ/mol | |
| B. | 2H2(g)+O2(g)=2H2O(1)△H>-483.6kJ/mol | |
| C. | 将含1mol NaOH的稀溶液与0.05mol浓硫酸溶液混合后放出的热量为57.3kJ | |
| D. | 将含1molBa(OH)2的稀溶液与含2mol HCl的稀溶液混合后放出的热量等于114.6kJ |
14.如表对于官能团的表示正确的是( )
| 羟基的电子式 | 酯基结构简式 | 碳碳双键结构简式 | 醛基电子式 |
| ${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H | -COOC- | C=C | 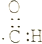 |
| A | B | C | D |
| A. | A | B. | B | C. | C | D. | D |
4.解释下列现象的化学用语不正确的是( )
| A. | CH3COONa溶液中,滴加酚酞变红:CH3COO-+H2O?CH3COOH+OH- | |
| B. | 向CU(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀黑色:Cu(OH)2(s)+S2-?CuS(s)+2OH- | |
| C. | 新制氯水中滴加NaOH溶液后,黄绿色褪去Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 铁钉在空气中出现红色的铁锈,其负极反应式为:Fe-3e-═Fe3+ |
11.下列有机物属于烷烃的是.( )
| A. | CH2=CH2 | B. | CH3CH2CH2CH2CI | C. | 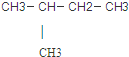 | D. | CH3CH2OH |
8.CH3-CH=CH-CH2-CH2Cl,该有机物能发生( )
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使KMnO4酸性溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦聚合反应.
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使KMnO4酸性溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦聚合反应.
| A. | 以上反应均可发生 | B. | 只有⑦不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
9.298K时,0.5molN2(g)与适量H2(g)转化成NH3(g)放出46.1kJ的热量,则表示该反应的热化学方程式正确的是( )
| A. | N2(g)+3H2(g)═2NH3(g)△H(298K)=+92.2kJ•mol-1 | |
| B. | N2(g)+3H2(g)═2NH3(g)△H(298K)=-92.2kJ•mol-1 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H(298K)=+46.1kJ•mol-1 | |
| D. | N2(g)+3H2(g)═2NH3(g)△H(298K)=-46.1kJ•mol-1 |