题目内容
向10mL 0.1mol·L-1 (NH4)Al(SO4)2溶液中滴加等浓度Ba(OH)2溶液x mL。下列表述正确的是
A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(SO42-)>c(NH4+)>c(Al3+)
B.x=20时溶液导电能力比x=15时溶液导电能力强
C.x=25时,溶液中主要有Ba2+、AlO2-,c(Ba2+)>c(AlO2-)
D.x=30时的离子方程式:NH4++Al3++2SO42-+2Ba2++5OH-→AlO2-+2BaSO4↓+NH3•H2O+2H2O
AD
【解析】
试题分析:根据题意,可得相关溶液和沉淀相关图像,a=10, a=15,a=20;
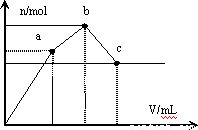
0→a,2Al3++3SO42-+3Ba2++6OH— = 2Al(OH)3↓+3BaSO4↓ 生成氢氧化铝沉淀和硫酸钡沉淀;a→b,SO42-+2NH4++2OH-+ Ba2+=2NH3·H2O+ BaSO4↓;b→c Al(OH)3+OH-=AlO2-+2H2O氢氧化铝溶解;b点为沉淀最大值,相关反应:NH4Al(SO4)2+ 2Ba(OH)2=2 BaSO4↓+ Al(OH)3↓+ NH3·H2O,则此时所耗掉Ba(OH)2的溶液体积为20mL;A、当x=10时,NH4Al(SO4)2与Ba(OH)2等物质的量反应,此时OH-量不足,OH-首先与Al3+反应,与NH4+不反应,2Al3++3SO42-+3Ba2++6OH— = 2Al(OH)3↓+3BaSO4↓,所以溶液中有未参加反应的NH4+和部分剩余的Al3+存在,同时SO42-也有剩余,但此时不会有AlO2-生成,溶液中c(NH4+)>c(Al3+),故A正确;选择AD。
考点:本题考查离子方程式的有关计算、过量计算等,难度中等,清楚氢氧根离子与铵根离子、铝离子反应的先后顺序是解题的关键。

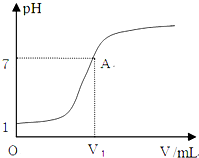 常温下,向10mL 0.1mol?L-1HCl溶液中逐滴加入0.1mol?L-1氨水,所得滴定曲线如图所示.下列说法正确的是( )
常温下,向10mL 0.1mol?L-1HCl溶液中逐滴加入0.1mol?L-1氨水,所得滴定曲线如图所示.下列说法正确的是( )| A、V1=10 mL | B、恰好中和时,溶液中:c(Cl-)≤c(NH4+) | C、A点溶液中存在:c(NH4+)=c(Cl-)=c(OH-)=c(H+) | D、当加入氨水的体积等于或小于10mL时,溶液中可能存在c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| A、用玻璃棒蘸取新制氯水,滴在pH试纸上,然后与比色卡对照,可测定新制氯水的pH | B、向10mL 0.1mol/L的AgNO3溶液中滴加10滴0.1mol/L的NaCl溶液,有白色沉淀生成,再向其中滴加0.1mol/L的KI溶液,沉淀变为黄色,说明相同温度下AgCl溶解度小于AgI的溶解度 | C、向1mL 1%的NaOH溶液中加入2mL 2%的CuSO4溶液,振荡,再加入0.5mL有机物Y,加热,未出现砖红色沉淀,说明Y中不含醛基 | D、取少量卤代烃Y在碱性溶液中水解,用硝酸酸化至酸性,再滴加AgNO3溶液,生成淡黄色沉淀,说明卤代烃中含有溴元素 |
 (2011?南京模拟)常温下,向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是( )
(2011?南京模拟)常温下,向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是( )