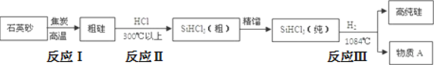
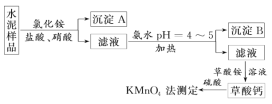
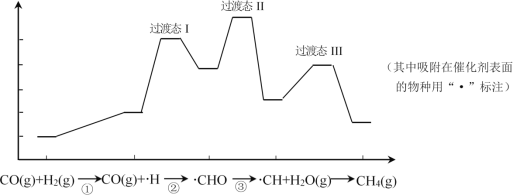
题目内容
【题目】如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应 X(g)+Y(g)![]() 2Z(g)+W(g);△H>0达到平衡时,VA=1.2aL,则下列说法错误的是:
2Z(g)+W(g);△H>0达到平衡时,VA=1.2aL,则下列说法错误的是:

A.反应开始时,B容器中化学反应速率快
B.A容器中X的转化率为40%,且比B容器中X的转化率大
C.打开K一段时间达平衡时,A的体积为1.6aL(连通管中气体体积不计)
D.打开K达新平衡后,升高B容器温度,A容器体积会增大
【答案】C
【解析】
由图可知,A保持恒压,B保持恒容.
A. 化学反应速率与物质的浓度有关,浓度越大反应速率越大;
B. 先根据相同条件下,气体的气体之比等于物质的量之比计算平衡后气体的物质的量,再结合方程式列三段式计算X参加反应的物质的量,最后根据转化率公式计算X的转化率,再结合A装置为恒压条件,相对于B来说,A容器相当于减压,分析化学平衡移动,判断X的转化率的大小关系;
C. 根据恒温恒容条件下,气体的体积之比等于物质的量之比,已知A中充入1molX和1molY的体积为1.2aL,则打开K,相当于充入了3molX和3molY,所以AB总体积为3.6aL,从而得出A的体积;
D. 升高温度,平衡向吸热方向移动。
A. 起始VA=VB=aL,B中的物质的量大于A中的物质的量,即B装置中的浓度大于A装置中的浓度,所以反应开始时,B反应速率大于A反应速率,A项正确;
B. 恒温恒压条件下,气体的体积之比等于气体的物质的量之比,达到平衡时,VA=1.2aL,是起始时容器容积的1.2倍,所以平衡后混合气体的物质的量应为起始时混合气体物质的量的1.2倍,共2.4mol,
设A物质反应了x mol,可列出三段式
X(g) + Y(g) 2Z(g) + W(g)
起始 1mol 1mol
转化 x mol x mol 2x mol x mol
平衡 (1-x)mol (1-x)mol 2x mol x mol 则1-x+1-x+2x+x=2.4mol
解得,x=0.4mol,所以A容器中X的转化率为![]() ;A装置为恒温恒压条件,该反应向正反应方向进行时,混合气体的物质的量增大,导致A容器容积增大,相对于B来说,A容器相当于减压,而减压平衡会向气体体积增大的正反应方向移动,所以A容器中X的转化率比B大,B项正确;
;A装置为恒温恒压条件,该反应向正反应方向进行时,混合气体的物质的量增大,导致A容器容积增大,相对于B来说,A容器相当于减压,而减压平衡会向气体体积增大的正反应方向移动,所以A容器中X的转化率比B大,B项正确;
C. 当打开K时,整个装置是在恒温恒压条件下反应,使整个装置中气体的压强与A装置中的初始压强相同,向A中充入1molX和1molY达到平衡时,VA=1.2aL;当打开K时,AB中气体共为3molX和3molY,由于整个装置是在恒温恒压条件下的反应,达到平衡状态时,混合气体的体积是3.6aL,其中B是aL,所以A是3.6aLaL=2.6aL,故C错误;
D. 打开K后,装置为恒压条件,该反应是吸热反应,所以升高温度,平衡正向移动,气体物质的量增大,则容器容积增大,则A容器的体积会增大,D项正确;
答案选C。