题目内容
A、B、C、D四种元素都是短周期元素,A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;5.8 g B的氢氧化物恰好能与100 mL 2 mol·L-1盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍。根据上述条件完成下列问题:
(1)元素C位于第________周期第________族,它的最高价氧化物的化学式为________。
(2)A元素是________,B元素是________,D元素是________。
(3)A与D形成稳定化合物的化学式是________,该化合物中存在化学键类型为________,判断该化合物在空气中是否变质的简单方法是
________________________________________。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为______________________________________________________________________________。
(1)元素C位于第________周期第________族,它的最高价氧化物的化学式为________。
(2)A元素是________,B元素是________,D元素是________。
(3)A与D形成稳定化合物的化学式是________,该化合物中存在化学键类型为________,判断该化合物在空气中是否变质的简单方法是
________________________________________。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为______________________________________________________________________________。
(1)3 ⅦA Cl2O7
(2)Na Mg O
(3)Na2O2 离子键 看表面颜色是否变白
(4)Cl2+2OH-====Cl-+ClO-+H2O
(2)Na Mg O
(3)Na2O2 离子键 看表面颜色是否变白
(4)Cl2+2OH-====Cl-+ClO-+H2O
由题所述,A元素是钠元素;根据题目所给条件和计算,B元素是镁元素;根据实验现象,C元素是氯元素,位于元素周期表的第3周期第ⅦA族;A和D元素所形成的稳定化合物是过氧化钠,判断过氧化钠是否变质,只要看表面颜色是否变白;氯气和氢氧化钠溶液反应的方程式为Cl2+2OH-====Cl-+ClO-+H2O。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
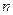 s2
s2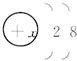 ,根据下列叙述,填写相应的微粒符号:
,根据下列叙述,填写相应的微粒符号: