题目内容
铁是地壳中含量较丰富的元素,仅次于氧、硅、铝元素,其单质及合金是在生产生活中应用广泛的金属材料.化学上常用KSCN溶液等来检验溶液中是否存在Fe3+.(1)Fe3+离子基态的电子排布式可表示为
(2)一种铁晶体的晶胞属于体心立方堆积,则该晶胞中所包括的铁原子的个数是
(3)C、N两种元素的简单气态氢化物的热稳定性由强到弱的顺序为
(4)C、N、O三种元素的第一电离能由大到小的顺序为
(5)离子化合物Fe2O3的熔点高于KC1的熔点的原因是
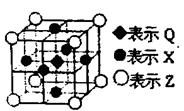
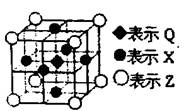
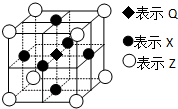
(6)据报道:由Q、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如右图所示.晶体中距每个X原子周围距离最近的Q的原子的个数是
分析:(1)Fe是26号原子,其原子核外有26个电子,失去3d上1个电子和4s上2个电子生成亚铁离子,根据构造原理书写铁离子基态的电子排布式;
(2)利用均摊法金属该晶胞中含有的铁原子个数;
(3)同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物越稳定;
(4)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素的第一电离能大于相邻元素;
(5)离子晶体中晶格能与离子半径成反比,与所带电荷成正比;
(6)利用均摊法确定Q原子个数.
(2)利用均摊法金属该晶胞中含有的铁原子个数;
(3)同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物越稳定;
(4)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素的第一电离能大于相邻元素;
(5)离子晶体中晶格能与离子半径成反比,与所带电荷成正比;
(6)利用均摊法确定Q原子个数.
解答:解:(1)Fe是26号原子,其原子核外有26个电子,失去3d上1个电子和4s上2个电子生成亚铁离子,根据构造原理知铁离子基态的电子排布式为1s22s22p63s23p63d5,故答案为:1s22s22p63s23p63d5;
(2)该晶体为体心立方,晶胞的每个顶点上有一个铁原子,体心上有一个铁原子,所以该晶胞中铁原子个数=8×
+1=2,故答案为:2;
(3)同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物越稳定,N元素的非金属性大于C元素,所以氢化物的稳定性NH3>CH4,故答案为:NH3>CH4;
(4)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素的第一电离能大于相邻元素,所以C、N、O这几种元素的第一电离能大小顺序是:N>O>C,
故答案为:N>O>C;
(5)离子晶体中晶格能与离子半径成反比,与所带电荷成正比,铁离子半径小于钾离子但电荷数大于钾离子,氧离子离子半径小于氯离子但电荷数大于氯离子,所以氧化铁的晶格能大于氯化钾,
故答案为:Fe2O3的晶格能大于KCl的晶格能;
(6)利用均摊法确定Q原子个数,每个X原子被两个晶胞共用,每个晶胞含有一个Q原子,所以晶体中距每个X原子周围距离最近的Q原子有2个,
故答案为:2.
(2)该晶体为体心立方,晶胞的每个顶点上有一个铁原子,体心上有一个铁原子,所以该晶胞中铁原子个数=8×
| 1 |
| 8 |
(3)同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物越稳定,N元素的非金属性大于C元素,所以氢化物的稳定性NH3>CH4,故答案为:NH3>CH4;
(4)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素的第一电离能大于相邻元素,所以C、N、O这几种元素的第一电离能大小顺序是:N>O>C,
故答案为:N>O>C;
(5)离子晶体中晶格能与离子半径成反比,与所带电荷成正比,铁离子半径小于钾离子但电荷数大于钾离子,氧离子离子半径小于氯离子但电荷数大于氯离子,所以氧化铁的晶格能大于氯化钾,
故答案为:Fe2O3的晶格能大于KCl的晶格能;
(6)利用均摊法确定Q原子个数,每个X原子被两个晶胞共用,每个晶胞含有一个Q原子,所以晶体中距每个X原子周围距离最近的Q原子有2个,
故答案为:2.
点评:本题考查了物质结构和性质,涉及晶胞的计算、基态离子核外电子排布式的书写、第一电离能、氢化物的稳定性等知识点,这些知识点都是考试热点,要熟练掌握这些知识点,难点是晶胞的金属,同时考查学生空间想象能力,难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目