题目内容
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在恒容密闭容器中N2O5可发生下列反应: 2N2O5(g) ≒ 4NO2(g) + O2(g).△H﹥0
(1)反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将________(填“增大”、“减小”、“不变”)。
(2)下表为反应在T1温度下的部分实验数据:
则,500s内N2O5的分解速率为_______________。
(3)在T2温度下,反应1000 s时测得NO2的浓度为4.98mol·L-1。则T2 __________ T1。(填“大于”“等于”或“小于”)
(1)反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将________(填“增大”、“减小”、“不变”)。
(2)下表为反应在T1温度下的部分实验数据:
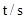 | 0 | 500 | 1000 |
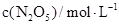 | 5.00 | 3.52 | 2.48 |
(3)在T2温度下,反应1000 s时测得NO2的浓度为4.98mol·L-1。则T2 __________ T1。(填“大于”“等于”或“小于”)
(1) 不变. (2) 2.96×10-3mol/(L.S). (3) 小于
(1)加入氮气,但不能改变反应物和生成物的浓度,因此平衡不移动,N2O5的转化率不变。
(2)500s内N2O5的浓度减少了(5.00-3.52)mol/L,所以其反应速率是1.48mol/L÷500s= 2.96×10-3mol/(L.S)。
(3)正反应是吸热反应,所以升高温度,平衡向正反应方向进行,NO2的浓度增大。但在温度为T1时,NO2的浓度是5.04mol/L,这说明T2小于T1。
(2)500s内N2O5的浓度减少了(5.00-3.52)mol/L,所以其反应速率是1.48mol/L÷500s= 2.96×10-3mol/(L.S)。
(3)正反应是吸热反应,所以升高温度,平衡向正反应方向进行,NO2的浓度增大。但在温度为T1时,NO2的浓度是5.04mol/L,这说明T2小于T1。

练习册系列答案
相关题目
 C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=" 0.100" mol·L-1 c(B)="0.200" mol·L-1c(C)="0" mol·L-1。反应物A的浓度随时间的变化如下图所示。下列说法正确的是
C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=" 0.100" mol·L-1 c(B)="0.200" mol·L-1c(C)="0" mol·L-1。反应物A的浓度随时间的变化如下图所示。下列说法正确的是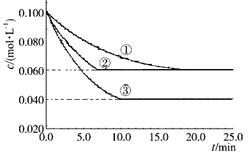
 2NH3(g);△H <0,在密闭容器中达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(H2)/c(NH3)与原平衡相比变小了,则改变条件的可能有
2NH3(g);△H <0,在密闭容器中达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(H2)/c(NH3)与原平衡相比变小了,则改变条件的可能有 xC(g)+2D(g)。5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论错误的是
xC(g)+2D(g)。5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论错误的是 a Z(g) + W(g) △H =-QkJ·mol-1 (Q>0)
a Z(g) + W(g) △H =-QkJ·mol-1 (Q>0)
 xC(g)+2D(g),2min末反应达到平衡状态, 生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态, 生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白: (6)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各4/3mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入 物质 mol。
(6)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各4/3mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入 物质 mol。 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O 2NO2 △H<0,当该反应处于平衡状态时,下列措施中有利于提高NO的平衡转化率的是 (填字母)。
2NO2 △H<0,当该反应处于平衡状态时,下列措施中有利于提高NO的平衡转化率的是 (填字母)。