题目内容
将4 mol SO3气体和4 mol NO置于2 L容器中,一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):2SO3(g)  2SO2+O2、2NO+O2
2SO2+O2、2NO+O2  2NO2
2NO2
⑴当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1 mol、n(NO2)=3.6 mol,则此时SO3气体的物质的量为 。
⑵当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和 ,或NO和 (填它们的分子式)。
⑶在其它条件不变的情况下,若改为起始时在1 L容器中充入2 molNO2和2 molSO2,则上述两反应达到平衡时,c(SO2)平= mol/L。
【答案】
⑴0.2 mol ⑵SO2、NO2 ⑶1.9
【解析】(1)NO2的物质的量是3.6mol,则消耗氧气的物质的量是1.8mol,所以最初生成的氧气是1.9mol,则分解的三氧化硫是3.8mol,所以平衡时三氧化硫的物质的量是0.2mol。
(2)根据原子守恒可知,两种气体一定不能同时是三氧化硫和二氧化硫,以及NO和NO2。
(3)根据题意可知,此时平衡一定是等效的,所以平衡时SO2的浓度还是1.9mol/L。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2SO2+O2?2NO+O2
2SO2+O2?2NO+O2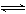 2SO2+O2?2NO+O2
2SO2+O2?2NO+O2