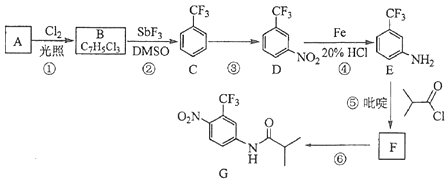
题目内容
【题目】向硫酸酸化的淀粉碘化钾溶液中滴入少量次氯酸钠溶液,溶液立即变蓝;再向上述溶液中滴加过量亚硫酸钠溶液,蓝色恰好完全褪去.
(1)碘化钾与次氯酸钠反应的离子方程式;+CIO﹣+I﹣═CI﹣+I2+
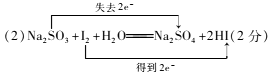
(2)用双线桥法表示电子得失的方向和数目:Na2SO3+I2+H2O═Na2SO4+2HI
(3)以上实验条件下,SO42﹣、I2和CIO﹣的氧化性有强到弱的顺序是 .
【答案】
(1)2H+;1;2;1;1;1H2O
(2)
(3)ClO﹣>I2>SO42﹣
【解析】解:(1)ClO﹣转化成Cl﹣化合价降低2价,I﹣转化成I2,化合价至少升高2价,则次氯酸根离子和碘单质的系数都是1,然后利用观察法配平可得:2H++2I﹣+ClO﹣=Cl﹣+H2O+I2,
所以答案是:2H+;1;2;1;1;1;H2O;(2)1molNa2SO3中S转移电子为2mol,1mol I2转化成HI转移电子是2mol,用双线桥法表示电子得失的方向和数目为:  ,
,
所以答案是:  ;(3)次氯酸根离子能够将碘离子氧化为碘单质,次氯酸根离子的氧化性比碘单质强,碘单质能够将氧化亚硫酸钠氧化为硫酸钠,碘单质的氧化性比
;(3)次氯酸根离子能够将碘离子氧化为碘单质,次氯酸根离子的氧化性比碘单质强,碘单质能够将氧化亚硫酸钠氧化为硫酸钠,碘单质的氧化性比
硫酸根离子强,所以SO42﹣、I2和CIO﹣的氧化性有强到弱的顺序是ClO﹣>I2>SO42﹣,
所以答案是:ClO﹣>I2>SO42﹣.

【题目】下列图象错误的是( )
|
|
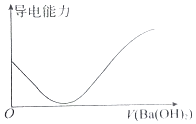
A.向100mL 0.1molL﹣1H2SO4溶液中滴加 | B.向100mL 0.1molL﹣1H2SO4溶液中加入NaOH固体 |
|
|
C.向一定浓度的氯化钠溶液中加水 | D.向蒸馏水中通入HCl气体 |
A.A
B.B
C.C
D.D
【题目】为了提纯下列物质(括号内为杂质),所选用的除杂试剂、分离方法、必用仪器都正确的是( )
选项 | 不纯物质 | 除杂试剂 | 分离方法 | 必用仪器 |
A | 碘水 | 四氯化碳 | 萃取 | 分液漏斗 |
B | 氯化钾(氯化钙) | 适量盐酸 | 过滤 | 玻璃棒 |
C | 硝酸铜(硝酸银) | 适量铜粉 | 结晶 | 酒精灯 |
D | 硫酸钾(碳酸钾) | 适量盐酸 | 蒸馏 | 温度计 |
A. A B. B C. C D. D