题目内容
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1 mol E单质与足量酸作用,在标准状况下能产生33.6 L H2;E的阳离子与A的阴离子核外电子层结构完全相同。
回答下列问题:

(1)A与E形成的化合物的化学式是 。
(2)B的最高价氧化物化学式为 ,C的元素名称为 ,D的单质与水反应的方程式为 ____________________________
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是
_____________________________________________________
有关反应的离子方程式为___________________________
回答下列问题:

(1)A与E形成的化合物的化学式是 。
(2)B的最高价氧化物化学式为 ,C的元素名称为 ,D的单质与水反应的方程式为 ____________________________
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是
_____________________________________________________
有关反应的离子方程式为___________________________
(1)Al2O3(1分)
(2)P2O5(1分) 硫(1分) Cl2+H2O HCl+HClO(2分)
HCl+HClO(2分)
(3)先有白色胶状沉淀产生并逐渐增多,随NaOH溶液的加入又逐渐溶解最终澄清(2分)
Al3++3OH-=Al(OH)3↓(2分),Al(OH)3+OH-=Al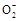 +2H2O(2分)
+2H2O(2分)
(2)P2O5(1分) 硫(1分) Cl2+H2O
 HCl+HClO(2分)
HCl+HClO(2分)(3)先有白色胶状沉淀产生并逐渐增多,随NaOH溶液的加入又逐渐溶解最终澄清(2分)
Al3++3OH-=Al(OH)3↓(2分),Al(OH)3+OH-=Al
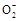 +2H2O(2分)
+2H2O(2分)设A、B、C、D四种元素原子的电子数分别为x-8、x-1、x、x+1,则(x-8)+(x-1)+x+(x+1)=56,x=16,A、B、C、D分别为O、P、S、Cl。根据1 mol E与足量酸反应生成的H2的体积为33.6 L,可知E为铝元素。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
