题目内容
(12分)纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛。以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下: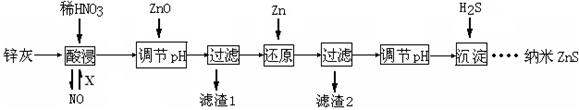
请回答下列问题。
(1)酸浸时FeO与稀HNO3反应的离子方程式 。
(2)将酸浸的尾气循环利用,加入的X气体可以是 。
(3)流程中加入ZnO调pH的目的是 。
(4)滤渣2中的成分是 。
(5)已知ZnS的溶度积Ksp=1.6×10-24,溶液中Zn2+浓度为0.01mol·L-1,则溶液中S2—浓度大于 mol·L一1,才生成ZnS沉淀。
(6)试设计简单实验方案,判断所得ZnS样品颗粒是否为纳米级 。
(1)3FeO+10H++NO3—=3Fe3++NO+5H2O (2分)
(2)空气(或O2) (2分)
(3)除去溶液中的Fe3+ (2分)
(4)Cu、Zn (2分)
(5)1.6×10—22 (2分)
(6)取少量样品和水混合形成分散系,让一束光照射,若出现一条光亮的通路,则是纳米级,否则不是。 (2分)
解析试题分析:(1)HNO3把FeO氧化为Fe3+,HNO3被还原为NO,配平可得离子方程式:3FeO+10H++NO3—=3Fe3++NO+5H2O
(2)NO与O2、H2O反应可生成HNO3,实现尾气循环利用,所以X气体为空气(或O2)。
(3)加入硝酸后,与Fe2O3、FeO反应生成Fe3+,流程中加入ZnO调pH可使Fe3+转化为Fe(OH)3沉淀,所以加入ZnO调pH的目的是除去溶液中的Fe3+
(4)加入Zn后,Zn与Cu2+反应生成Cu,所以滤渣2中的成分是Cu、Zn
(5)c(S2?)= Ksp÷c(Zn2+)=1.6×10-24÷0.01=1.6×10—22mol?L?1,所以溶液中S2—浓度大于1.6×10—22mol?L?1,才生成ZnS沉淀。
(6)纳米级颗粒与水混合可形成胶体,具有丁达尔效应,所以实验方案为:取少量样品和水混合形成分散系,让一束光照射,若出现一条光亮的通路,则是纳米级,否则不是。
考点:本题考查化学流程的分析、离子方程式的书写、除杂、胶体的性质、Ksp的计算。

胶体区别于其他分散系的本质特征是
| A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能 |
| B.产生丁达尔现象 |
| C.分散质粒子直径在1nm~100nm之间 |
| D.胶体在一定条件下能稳定存在 |
下列物质属于纯净物的是
| A.钢 | B.液氯 | C.空气 | D.氨水 |
下列各项说法或比较中不正确的是
| A.胶体区别于其他分散系的本质特征是丁达尔效应 |
| B.根据电离方程式HCl=H++Clˉ,判断HCl分子里存在离子键 |
| C.氧化性由强到弱顺序:Ag+>Fe3+>Cu2+ |
| D.250C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
I .用序号回答下列各题:
① 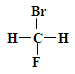 和
和 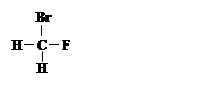
②1H—、2H、3H +、D2 ③淀粉和纤维素
④ 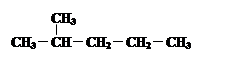 和
和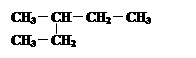
⑤16O2、18O3 ⑥235U、238U
其中互为同位素的是 。
互为同素异形体的是 。
互为同分异构体的是 。
是同一种化合物的是 。
II. 请选择合适的试剂检验某物质中是否含括号内物质:
| 序号 | 原物质(需检验物质) | 试剂 |
| ① | CO2(SO2) | |
| ② | 乙醇(水) | |
| ③ | 直馏汽油( 裂化汽油) | |
Ⅲ.某元素R气态氢化物化学式为HnR。若最高价氧化物对应水化物分子中有b个氧原子,则其最高价氧化物对应水化物化学式通常表达为 。(含n和b)


 ④氕、氘、氚
④氕、氘、氚