题目内容
固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,其工作原理如下图所示。下列关于固体
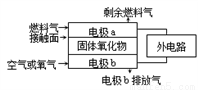
燃料电池的有关说法中正确的是
A. 固体氧化物的作用是让电子在电池内通过
B. 固体氧化物中O2-从a极向b极移动
C. 电极b为电池的负极,电极反应式为:O2 + 4e- = 2O2-
D. 若以C3H8为燃料气,则接触面上发生的反应为C3H8 – 20e- + 10O2- =3CO2 +4H2O
 阅读快车系列答案
阅读快车系列答案H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
I.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为________________________。
II.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为____________。
(3)己知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27,该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通人H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=_________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g) H2S(g)+CO(g) △H=+7 kJ·mol-1;
H2S(g)+CO(g) △H=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
CO2(g)+H2(g) △H =-42 kJ·mol-1 ;
(4)己知:断裂1 mol分子中的化学键所需吸收的能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/ kJ·mol-1 | 1319 | 442 | x | 678 | -930 | 1606 |
表中x=___________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。

①随着温度升高,CO的平衡体积分数____________(填“增大”或“减小”),原因为_______________。
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_________;反应i的平衡常数为____________(保留两位有效数字)。


 C(s)+D(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+D(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
 L-1的NaCl溶液,通电一段时间后发现两极收集的气体体积之比为4:3,下列说法正确的是( )
L-1的NaCl溶液,通电一段时间后发现两极收集的气体体积之比为4:3,下列说法正确的是( )