题目内容
 (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(1)用化学符号表示下列4种微粒:
A______;B______;C______;D______.
(2)写出A、B、E三种微粒反应的离子方程式:______.
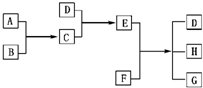
(Ⅱ)已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:
请回答下列问题:
(1)D的化学式是______,E的化学式是______.
(2)A和B反应生成C的化学方程式是:______.
(3)E和F反应生成D、H和G的化学方程式是:______.
解:(Ⅰ)(1)10电子微粒有:H2O、NH3、CH4、HF、NH4+、OH-、Al3+、Na+、O2-、F-等微粒,A、B、E三种微粒反应后可得C和一种白色沉淀,该白色沉淀为Al(OH)3或Mg(OH)2,应为Al3+或Mg2+和氨水溶液的反应,则C为NH4+,B溶于A,说明A为H2O,B为NH3,D应为OH-,故答案为:H2O;NH3;NH4+;OH-;
(2)氨水溶液呈碱性,Al3+或Mg2+和氨水溶液的反应生成Al(OH)3或Mg(OH)2,
反应的离子方程式为Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+,
故答案为:Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+;
(Ⅱ)反应对应氨气→铵盐→氨气这一过程.也就是D为NH3,结合G为CaCl2可以知道E为NH4Cl,F为Ca(OH)2,其余物质可以逐一确定为A-H2(或Cl2)、B-Cl2(或H2)、C-HCl、H-H2O,则
(1)D为NH3,E为NH4Cl,故答案为:NH3;NH4Cl;
(2)H2和Cl2在点燃条件下反应生成HCl,反应的化学方程式为H2+Cl2 2HCl,故答案为:H2+Cl2
2HCl,故答案为:H2+Cl2 2HCl;
2HCl;
(3)实验室用NH4Cl和Ca(OH)2在加热条件下反应制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2 2NH3↑+2H2O+
2NH3↑+2H2O+
CaCl2,
故答案为:2NH4Cl+Ca(OH)2 2NH3↑+2H2O+CaCl2.
2NH3↑+2H2O+CaCl2.
分析:(Ⅰ)10电子微粒有:H2O、NH3、CH4、HF、NH4+、OH-、Al3+、Na+、O2-、F-等微粒,A、B、E三种微粒反应后可得C和一种白色沉淀,该白色沉淀为Al(OH)3或Mg(OH)2,应为Al3+或Mg2+和氨水溶液的反应,则C为NH4+,B溶于A,说明A为H2O,B为NH3,D应为OH-;
(Ⅱ)本题的突破口在于D→E→D这一系列过程,其对应氨气→铵盐→氨气这一过程.也就是D为NH3,结合G为CaCl2可以知道E为NH4Cl,F为Ca(OH)2,其余物质可以逐一确定为A-H2(或Cl2)、B-Cl2(或H2)、C-HCl、H-H2O.
点评:本题考查无机物的推断,题目难度不大,本题注意把握常见10电子微粒和18电子微粒,学习中注意相关基础知识的积累.
(2)氨水溶液呈碱性,Al3+或Mg2+和氨水溶液的反应生成Al(OH)3或Mg(OH)2,
反应的离子方程式为Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+,
故答案为:Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+;
(Ⅱ)反应对应氨气→铵盐→氨气这一过程.也就是D为NH3,结合G为CaCl2可以知道E为NH4Cl,F为Ca(OH)2,其余物质可以逐一确定为A-H2(或Cl2)、B-Cl2(或H2)、C-HCl、H-H2O,则
(1)D为NH3,E为NH4Cl,故答案为:NH3;NH4Cl;
(2)H2和Cl2在点燃条件下反应生成HCl,反应的化学方程式为H2+Cl2
 2HCl,故答案为:H2+Cl2
2HCl,故答案为:H2+Cl2 2HCl;
2HCl; (3)实验室用NH4Cl和Ca(OH)2在加热条件下反应制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2
 2NH3↑+2H2O+
2NH3↑+2H2O+CaCl2,
故答案为:2NH4Cl+Ca(OH)2
 2NH3↑+2H2O+CaCl2.
2NH3↑+2H2O+CaCl2.分析:(Ⅰ)10电子微粒有:H2O、NH3、CH4、HF、NH4+、OH-、Al3+、Na+、O2-、F-等微粒,A、B、E三种微粒反应后可得C和一种白色沉淀,该白色沉淀为Al(OH)3或Mg(OH)2,应为Al3+或Mg2+和氨水溶液的反应,则C为NH4+,B溶于A,说明A为H2O,B为NH3,D应为OH-;
(Ⅱ)本题的突破口在于D→E→D这一系列过程,其对应氨气→铵盐→氨气这一过程.也就是D为NH3,结合G为CaCl2可以知道E为NH4Cl,F为Ca(OH)2,其余物质可以逐一确定为A-H2(或Cl2)、B-Cl2(或H2)、C-HCl、H-H2O.
点评:本题考查无机物的推断,题目难度不大,本题注意把握常见10电子微粒和18电子微粒,学习中注意相关基础知识的积累.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
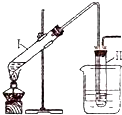 实验室用如图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL蒸馏水、4mL浓硫酸、2mL95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.已知:通常情况下,溴乙烷呈液态,其密度比水大且不溶于水.试回答下列问题:
实验室用如图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL蒸馏水、4mL浓硫酸、2mL95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.已知:通常情况下,溴乙烷呈液态,其密度比水大且不溶于水.试回答下列问题:(1)试管Ⅰ中硫酸和溴化钠加热反应生成氢溴酸.写出氢溴酸与乙醇在加热时反应的化学方程式
(2)在反应发生后试管II中可观察到的现象是
(3)溴乙烷为无色油状液体.若试管II中获得的有机物呈棕黄色,除去其中的杂质应选用的试剂是
A.CCl4 B.NaOH溶液 C.Na2SO3溶液
利用上述试剂充分洗涤后,分离混合物的操作是
(4)设计实验证明有机物溴乙烷中含有溴元素.完成以下实验报告:
| 实验步骤 | 实验操作 | 预期现象和结论 | ① | 取少量除杂后的溴乙烷于试管中, |
② | 取①中反应后的上层清液少量于另一支试管中, |