题目内容
将标准状况下6.72 L的CO2通入含14.8 g Ca(OH)2的石灰水中,所得沉
淀的质量是( )
淀的质量是( )
| A.1 g | B.10 g | C.20 g | D.30 g |
B
试题分析:CO2和氢氧化钙的物质的量分别是6.72L÷22.4L/mol=0.3mol、14.8g÷74g/mol=0.2mol,则反应中CO2过量,有碳酸氢钙生成。所以根据反应的方程式CO2+Ca(OH)2=CaCO3↓+H2O、CaCO3+CO2+H2O=Ca(HCO3)2可知所得沉淀的质量是(0.2mol-0.1mol)×100g/mol=10.0g,答案选B。2和石灰水反应的有关计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的训练,有利于提高学生的逻辑推理能力。该题的关键是明确反应的原理,然后结合方程式灵活运用即可。

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
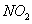 通入
通入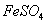 溶液中
溶液中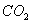 通入
通入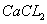 溶液中
溶液中 溶液中
溶液中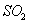 通入
通入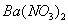 溶液中
溶液中