题目内容
【题目】已知:CH3—CH===CH2+HBr→CH3—CHBr—CH3(主要产物),1 mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下面所示的一系列变化。

(1)A的化学式:________,A的结构简式________。
(2)上述反应中,①是________反应,⑦是________反应。(填反应类型)
(3)写出C,D,E,H物质的结构简式:C___________,D________,E________,H___________。
(4)写出⑥反应的化学方程式___________________________________。
写出⑦反应的化学方程式___________________________________。
【答案】 C8H8 ![]() 加成 酯化(取代)
加成 酯化(取代) 


 略 略
略 略
【解析】1mol某烃A充分燃烧后可以得到8molCO2和4molH2O,故烃A的分子式为C8H8,不饱和度为(2×8+28)/2=5,可能含有苯环,由A发生加聚反应生成C,故A中含有不饱和键,故A为![]() ,C为
,C为 ,A与溴发生加成反应生成B,则B为
,A与溴发生加成反应生成B,则B为 ,B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,则E为
,B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,则E为![]() ,E与溴发生加成反应生成
,E与溴发生加成反应生成![]() ,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,故A与HBr放出加成反应生成D,则D为
,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,故A与HBr放出加成反应生成D,则D为![]() ,D在氢氧化钠水溶液、加热条件下发生水解反应生成F,则F为
,D在氢氧化钠水溶液、加热条件下发生水解反应生成F,则F为![]() ,F与乙酸发生酯化反应生成H,故H为
,F与乙酸发生酯化反应生成H,故H为![]() ,则
,则
(1)由上述分析可知,A的分子式为C8H8,A的结构简式:![]() ;(2)上述反应中,反应①是A与溴发生加成反应生成B,反应⑦是F与乙酸发生酯化反应;(3)由上述分析可知,C、D、E、H的结构简式分别是
;(2)上述反应中,反应①是A与溴发生加成反应生成B,反应⑦是F与乙酸发生酯化反应;(3)由上述分析可知,C、D、E、H的结构简式分别是 、
、![]() 、
、![]() 、
、![]() ;(4)D→F是D在氢氧化钠水溶液、加热条件下发生水解反应生成F,反应方程式为
;(4)D→F是D在氢氧化钠水溶液、加热条件下发生水解反应生成F,反应方程式为 。⑦是酯化反应,反应的化学方程式
。⑦是酯化反应,反应的化学方程式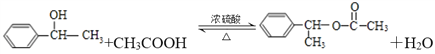 。
。



