��Ŀ����
����Ŀ����2017һģ����þ�����������仯���������������������Ź㷺��Ӧ��
I��ʵ���Ҳ���MgCl2��AlCl3�Ļ����Һ�������ˮ��Ӧ�Ʊ�MgAl2O4����Ҫ�������£�
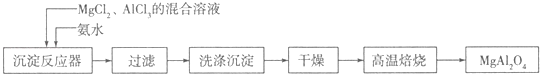
(1)��֪25��ʱKsp[Mg(OH)2]=1.8��10��11��Ksp[Al(OH)2]=3��10��34�����¶�����Ũ�Ⱦ�Ϊ0.01molL��1��MgCl2��AlCl3�����Һ����μ��백ˮ�������� ����(�ѧʽ)��
(2)���±���ʱ������Ӧ�Ļ�ѧ����ʽ ��ϴ�ӳ���ʱ�ķ����� ��
(3)�����������AlCl3������Һ�в���ͨ��HCl���壬������AlCl36H2O���壬��ϻ�ѧƽ���ƶ�ԭ���������������ԭ�� ��
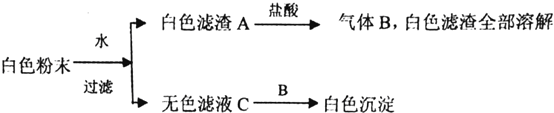
����ij��ȤС���ͬѧ���ֽ�һ����������Ũ�������ʱ���۲쵽����ȫ�ܽ⣬�������������壮Ϊ�ˣ��������������װ����֤�����������壮
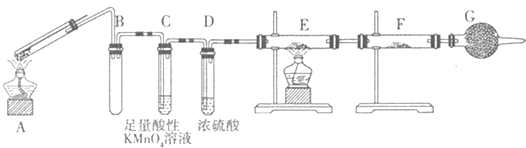
(1)Gװ�õ������� ��
(2)֤����SO2���ɵ������� ��Ϊ��֤�������к���������װ��E��F�м�����Լ��ֱ�Ϊ �� ��
(3)������˿����ͭ˿����Ӧ�����Һû�г���Ԥ�Ƶ���ɫ��Һ���������˴�����ɫ���壬ԭ���� ��
���𰸡�I��(1)Al(OH)3 (2)2Al(OH)3+Mg(OH)2![]() MgAl2O4+4H2O�� ��©���м�ˮ����û��������ˮ��Ȼ���ɺ����ظ�2��3�� (3)AlCl3������Һ�д����ܽ�ƽ�⣺AlCl36H2O(s)
MgAl2O4+4H2O�� ��©���м�ˮ����û��������ˮ��Ȼ���ɺ����ظ�2��3�� (3)AlCl3������Һ�д����ܽ�ƽ�⣺AlCl36H2O(s)![]() Al3+(aq)+3Cl��(aq)+6H2O(l)��ͨ��HCl����ʹ��Һ��c(Cl��)����ƽ������������ķ����ƶ��Ӷ�����AlCl3���� ����(1)��ֹ�����е�ˮ����F (2)���Ը��������Һ��ɫ��ɫ ����ͭ ��ˮ����ͭ (3)Ũ�����е�ˮ����
Al3+(aq)+3Cl��(aq)+6H2O(l)��ͨ��HCl����ʹ��Һ��c(Cl��)����ƽ������������ķ����ƶ��Ӷ�����AlCl3���� ����(1)��ֹ�����е�ˮ����F (2)���Ը��������Һ��ɫ��ɫ ����ͭ ��ˮ����ͭ (3)Ũ�����е�ˮ����
����������(1)���ܵ���ʵ��ܶȻ�ԽС�����백ˮʱԽ�����ɳ�������֪25��ʱKsp[Mg(OH)2]=1.8��10��11��Ksp[Al(OH)3]=3��10��34�����������ȳ�����
(2)����������ΪAl(OH)3��Mg(OH)2�����±��ձ�MgAl2O4ʱ������Ӧ�Ļ�ѧ����ʽ2Al(OH)3+Mg(OH)2![]() MgAl2O4+4H2O��ϴ�ӳ���ʱ�ķ����� ��©���м�ˮ����û��������ˮ��Ȼ���ɺ����ظ�2��3����
MgAl2O4+4H2O��ϴ�ӳ���ʱ�ķ����� ��©���м�ˮ����û��������ˮ��Ȼ���ɺ����ظ�2��3����
(3)�Ȼ�������Һ�д����ܽ�ƽ�⣬ͨ���Ȼ������Һ��������Ũ�����������Ȼ����ܽ⣬���Դٽ��Ȼ�������������
��(1)���û��Gװ�ã�ˮ��������Fװ�ø���ʵ�飬����G�������ǣ���ֹ�����е�H2O����F��
(2)���������л�ԭ�ԣ����Ը��������ǿ�����ԣ������ܷ���������ԭ��Ӧ��ʹ���Ը��������Һ��ɫ�������л�ԭ���ܺ�����ͭ�ڼ��������·����û���Ӧ����ͭ���ʣ����ɵ�ˮ����ˮ����ͭʱ��ɫ�������ɫ��Ϊ��֤�������к���������װ��E��F�м�����Լ��ֱ�Ϊ ����ͭ����ˮ����ͭ��
(3)��ΪŨ�����е�ˮ���٣���Ӧ�����ɵ�����ͭ���û���ܽ����Ԥ�Ƶ���ɫ��Һ���������˴�����ɫ������

 ������ʱͬ����ϰ��ϵ�д�
������ʱͬ����ϰ��ϵ�д�����Ŀ�������ҹ���������ij�еȳ�����Ϣͼ�����ش��������⡣
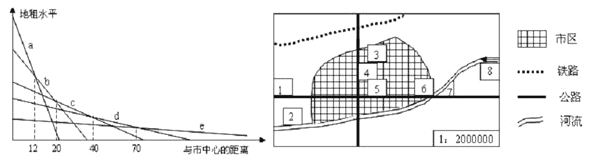
��1��ͼ��a��e��ʾС����ֲҵ����������ţҵ����ҵ����ҵ��סլ�õظ������������ݼ���������뽫��ͼ��������ĸ������к��ʵ�λ�á�
�õ����� | С����ֲҵ | ��������ţҵ | ��ҵ | ��ҵ | סլ�õ� |
��ĸ | e |
��2���г��������漤�ң�����ÿһ�����ص���;��Ҫȡ���ڸ��ֻ_________________�����ĸߵ͡���ͼ��֪���ھ���������_________________���ﷶΧ�ڣ����п����γ�סլ����
��3�����ݵ���ˮƽ�ĸߵͣ��ۺϿ��ǻ��������أ�������Ӧѡ����1��2��3��4�Ĵ��е�____________����ѡ��������____________________________________________________________________��
��4��ͼ�����ִ����ij��й��ܷ�������ȷ����_________________��ѡ����գ���
A��5�����ͳ��� B��6��С����ֲ C��7���ɻ��� D��8��������