题目内容
【题目】【2016浙江二模】某溶液X中可能含有NO3﹣、Cl﹣、SO42﹣、CO32﹣、NH4+、Fe2+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等.为确定该溶液X的成分,某学习小组做了如下实验:
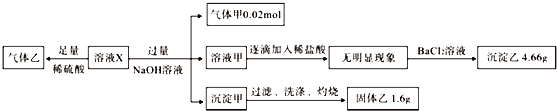
则下列说法正确的是( )
A.若含有Fe3+,则一定含有Cl﹣
B.SO42﹣、NH4+一定存在,NO3﹣、Cl﹣可能不存在
C.CO32﹣、Al3+、K+一定不存在
D.气体甲、沉淀甲一定为纯净物
【答案】A
【解析】某溶液X中可能含有NO3﹣、Cl﹣、SO42﹣、CO32﹣、NH4+、Fe2+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等,向溶液X中加过量的硫酸,有气体乙产生,发生的反应可能是CO32﹣与H+的反应,也可能是NO3﹣在H+条件下与Fe2+的氧化还原反应;溶液X与过量的NaOH溶液反应生成气体甲NH3为0.02mol,即溶液X中含0.02molNH4+;所得的溶液甲中逐滴加入稀盐酸,无现象,故溶液X中无Al3+;再继续加氯化钡溶液,生成沉淀乙,则乙为BaSO4,质量为4.66g,则物质的量为0.02mol,即溶液X中含0.02molSO42﹣;所得沉淀甲应为Fe(OH)2或Fe(OH)3或两者均有,经过滤、洗涤灼烧后所得的固体乙为Fe2O3,质量为1.6g,物质的量为0.01mol,故溶液X中含Fe2+或Fe3+或两者均有,且物质的量一定为0.02mol,由于Fe2+或Fe3+均能与CO32﹣发生双水解而不能共存,故溶液中无CO32﹣,则生成气体乙的反应只能是NO3﹣与Fe2+的氧化还原反应,故溶液中一定含Fe2+和NO3﹣,而所含阴离子的物质的量相等,即NO3﹣的物质的量也为0.02mol;故现在溶液X中已经确定存在的离子是:阴离子:0.02molNO3﹣,0.02molSO42﹣,共带0.06mol负电荷; 阳离子:0.02molNH4+,0.02molFe2+或Fe2+、Fe3+的混合物,所带的正电荷≥0.06mol,一定不含Al3+、CO32﹣;根据溶液呈电中性可知,当 0.02mol全部是Fe2+时,阳离子所带正电荷为0.06mol,则Cl﹣可以存在,也可以不存在,若Cl﹣存在,则K+一定存在,若Cl﹣不存在,则K+一定不存在;若溶液中含Fe3+,阳离子所带正电荷大于0.06mol,则溶液中一定存在Cl﹣,还可能存在K+.故溶液中可能含Cl﹣、K+;A.由于溶液要保持电中性,故当溶液中含Fe3+时,则阳离子所带的正电荷>0.06mol,故溶液中一定含Cl﹣,故A正确;B.溶液中NO3﹣一定存在,故B错误;C.K+可能存在,故C错误;D.气体甲为氨气,是纯净物,但沉淀甲可能是Fe(OH)2或Fe(OH)3或两者均有,不一定是纯净物,故D错误;故选A。

【题目】下图为世界经纬网示意图,读图回答下列问题。
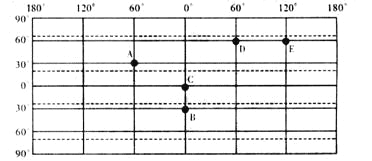
(1)若某日A点和B点的正午太阳高度相同,则太阳直射点位于 (纬度)。
(2)如果一架飞机从B点上空于地方时12点 出发向北飞行,3小时后到达C 点上空。飞机飞行距离约( )
A.2580千米 | B.3330千米 | C.6660千米 | D.2266千米 |
(3)若另一架飞机同时以相同的速度从D点上空开始沿纬线向E点上空飞行。则该飞机全程飞行需要 小时,到达E地上空时,E地的地方时为 。
(4)若A点某日昼夜平分,且时刻为14:00,在图中用阴影画出这一时刻夜半球的范围。