题目内容
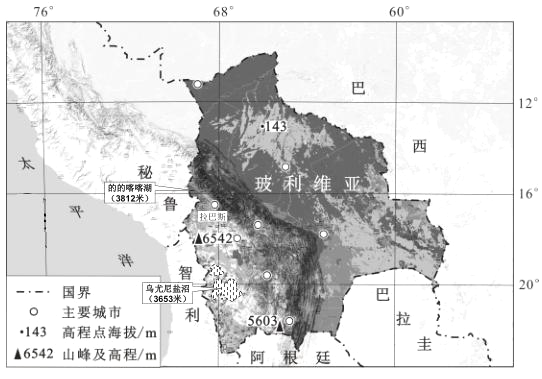
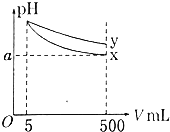
【题目】【2017榆林一模】常温下,各取1mL,PH=2的,两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
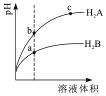
A.H2A的酸性比H2B弱
B.C点溶液的导电性比a、b点溶液的导电性都强
C.若0.1molL﹣1NaHA溶液的PH=4,离子浓度大小为c(Na+)>c(HA﹣)>c(A2﹣)>c(H2A)>c(H+)>c(OH﹣)
D.N2B的水溶液中,离子浓度大小为c(Na+)>c(B2﹣)>c(OH﹣)>c(H+)
【答案】D
【解析】A.弱酸中存在电离平衡,加水稀释促进弱酸电离,稀释时,如果是强酸,则溶液的pH增大多,弱酸pH增大的少,所以H2A的酸性比H2B强,故A错误;B.溶液中氢离子浓度越大,导电性越强,a点的pH最小,氢离子浓度最大,所以a点溶液的导电性最强,故B错误;C.若0.1molL﹣1NaHA溶液的PH=4,溶液显酸性,HA﹣的电离程度大于水解程度,则c(A2﹣)>c(H2A),所以离子浓度大小为c(Na+)>c(HA﹣)>c(H+)>c(A2﹣)>c(OH﹣)>c(H2A),故C错误;D.H2B为弱酸,Na2B的水溶液显碱性,则溶液中离子浓度大小为c(Na+)>c(B2﹣)>c(OH﹣)>c(H+),故D正确;故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目