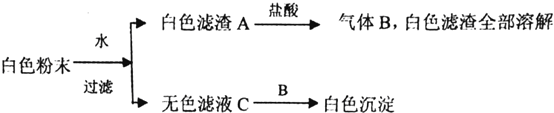
题目内容
【题目】【2017江西一模】已知氯化亚铁的熔点674℃、沸点1023℃;三氯化铁在300℃以上易升华,易溶于水并且有强烈的吸水性.在500℃条件下氯化亚铁与氧气可能发生多种反应,反应之一为:12FeCl2+3O2![]() 2Fe2O3+8FeCl3.某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行反应的探究.回答下列问题:
2Fe2O3+8FeCl3.某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行反应的探究.回答下列问题:
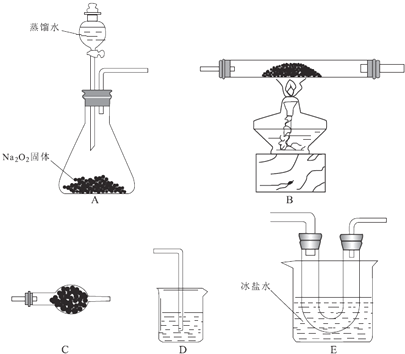
(1)装置的合理连接顺序为A、 、D,其中E装置U形管左边设计为粗导管的目的是 ;
(2)A装置中发生反应的化学方程式为 ;
(3)反应过程发现,装置B中除生成红棕色固体外,还观察到黄绿色气体,生成该气体的化学方程式为 ;
(4)待B中充分反应后,停止加热后,还需持续通氧气至 ;
(5)设计实验:
①利用E装置U形管里的固体验证Fe(OH)3是弱碱: ;
②测定装置B的残留固体中铁元素的质量分数: 。
【答案】(1)CBEC 防止FeCl3冷凝在导管中,堵塞导管
(2) 2Na2O2+2H2O=4NaOH+O2↑ (3) 4FeCl2+3O2![]() 2Fe2O3+4Cl2 (4) 硬质玻璃管冷却到室温且装置中的黄绿色气体完全消失 (5)① 取少量固体加水溶解,用pH试纸(或pH计)测得溶液显酸性,即证 ②称取一定质量B中的残留固体,加入足量的盐酸(或硫酸等)溶解,加足量的H2O2氧化后(不答也可)再加入足量氢氧化钠溶液得沉淀,过滤、洗涤、在空气中充分灼烧至恒重称量
2Fe2O3+4Cl2 (4) 硬质玻璃管冷却到室温且装置中的黄绿色气体完全消失 (5)① 取少量固体加水溶解,用pH试纸(或pH计)测得溶液显酸性,即证 ②称取一定质量B中的残留固体,加入足量的盐酸(或硫酸等)溶解,加足量的H2O2氧化后(不答也可)再加入足量氢氧化钠溶液得沉淀,过滤、洗涤、在空气中充分灼烧至恒重称量
【解析】(1)氯化亚铁制取氯化铁的性质实验:反应原理为:12FeCl2+3O2![]() 2Fe2O3+8FeCl3.首先制取氧气,装置A:2Na2O2+2H2O=4NaOH+O2↑,制取的氧气中含有水蒸气,因三氯化铁易溶于水并且有强烈的吸水性,需除去氧气中的水蒸气,选用装置C,在500℃条件下氯化亚铁与氧气可能发生多种反应,装置B中:12FeCl2+3O2
2Fe2O3+8FeCl3.首先制取氧气,装置A:2Na2O2+2H2O=4NaOH+O2↑,制取的氧气中含有水蒸气,因三氯化铁易溶于水并且有强烈的吸水性,需除去氧气中的水蒸气,选用装置C,在500℃条件下氯化亚铁与氧气可能发生多种反应,装置B中:12FeCl2+3O2![]() 2Fe2O3+8FeCl3,同时发生副反应4FeCl2+3O2
2Fe2O3+8FeCl3,同时发生副反应4FeCl2+3O2![]() 2Fe2O3+4Cl2,待B中充分反应后,停止加热后,还需持续通氧气至硬质玻璃管冷却到室温且装置中的黄绿色气体完全消失,三氯化铁在300℃以上易升华,利用装置E浓盐水冷却氯化铁,E装置U形管左边设计为粗导管的目的是防止FeCl3冷凝在导管中,堵塞导管,最后用装置D盛放碱性溶液吸收尾气;
2Fe2O3+4Cl2,待B中充分反应后,停止加热后,还需持续通氧气至硬质玻璃管冷却到室温且装置中的黄绿色气体完全消失,三氯化铁在300℃以上易升华,利用装置E浓盐水冷却氯化铁,E装置U形管左边设计为粗导管的目的是防止FeCl3冷凝在导管中,堵塞导管,最后用装置D盛放碱性溶液吸收尾气;
(2)装置A中过氧化钠和水反应生成氢氧化钠和氧气,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑;
(3)装置B中生成红棕色固体为氧化铁,观察到黄绿色气体为氯气,氯化亚铁和氧气反应生成氧化铁和氯气,反应方程式为:4FeCl2+3O2![]() 2Fe2O3+4Cl2;
2Fe2O3+4Cl2;
(4)待B中充分反应后,停止加热后,还需持续通氧气,至硬质玻璃管冷却到室温且装置中的黄绿色气体完全消失,保证装置B中:12FeCl2+3O2![]() 2Fe2O3+8FeCl3,反应完全;
2Fe2O3+8FeCl3,反应完全;
(5)①验证Fe(OH)3是弱碱,可通过氯化铁为强酸弱碱盐水解呈酸性进行检验,取少量固体加水溶解,用pH试纸(或pH计)测得溶液显酸性,即证;
②测定装置B的残留固体中铁元素的质量分数,可通过测定氧化铁实验,操作为:称取一定质量B中的残留固体,加入足量的盐酸(或硫酸等)溶解,加足量的H2O2氧化后,再加入足量氢氧化钠溶液得沉淀,过滤、洗涤、在空气中充分灼烧至恒重称量。