题目内容
【题目】为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如下图所示的实验装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
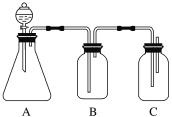
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为________。
(2)装置B所盛的试剂是__________,其作用是__________________________________。
(3)装置C所盛试剂是________,C中反应的离子方程式是______________________________________。
(4)由此得到的结论是酸性:________>________>________。
【答案】(1)盐酸
(2)饱和NaHCO3溶液 吸收HCl气体
(3)Na2SiO3溶液 ![]() +CO2+H2O===H2SiO3↓+
+CO2+H2O===H2SiO3↓+![]() (或
(或![]() +2CO2+2H2O===2
+2CO2+2H2O===2![]() +H2SiO3↓)
+H2SiO3↓)
(4)HCl H2CO3 H2SiO3
【解析】根据“强酸+弱酸盐―→弱酸+强酸盐”分析可知,分液漏斗中盛装盐酸,A中盛放Na2CO3,根据Na2CO3+2HCl===2NaCl+H2O+CO2↑可以知道酸性HCl强于H2CO3,然后将生成的CO2通入Na2SiO3溶液中,反应为Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3,由此判断酸性H2CO3>H2SiO3,但需注意的是A中反应会有HCl气体逸出,故通入Na2SiO3溶液前需将HCl吸收,但不能吸收CO2,故选用饱和NaHCO3溶液。

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目