题目内容
【题目】【2017昆明二模】室温下,浓度均为0.1molL﹣1、体积均为V0HA、HB溶液,分别加水稀释至V,pH随lg![]() 的变化如图所示,下列说法正确的是( )
的变化如图所示,下列说法正确的是( )
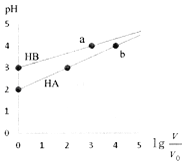
A.HA为强酸,HB为弱酸
B.水的电离程度a点大于b点
C.当pH=2时,HA溶液中![]() =9
=9
D.等浓度等体积的HB与Na0H溶液充分反应后,离子浓度关系大小为:c(B﹣)>c(Na+)>c(H+)>c(OH﹣)
【答案】C
【解析】A.当lg![]() =1,也就是溶液稀释10倍,但PH变化都不到1个单位,所以HA和HB都为弱酸,故A错误;B.两种酸对水的电离都起抑制作用,氢离子的浓度越大水的电离程度越小,而a、b两点氢离子的浓度相同,所以水的电离程度相同,故B错误;C.当pH=2时,也就是c(H+)=c(A﹣)=10﹣2mol/L,而c(HA)=0.1﹣0.01=0.09mol/L,所以HA溶液中
=1,也就是溶液稀释10倍,但PH变化都不到1个单位,所以HA和HB都为弱酸,故A错误;B.两种酸对水的电离都起抑制作用,氢离子的浓度越大水的电离程度越小,而a、b两点氢离子的浓度相同,所以水的电离程度相同,故B错误;C.当pH=2时,也就是c(H+)=c(A﹣)=10﹣2mol/L,而c(HA)=0.1﹣0.01=0.09mol/L,所以HA溶液中![]() =9,故C正确;D.等浓度等体积的HB与NaOH溶液充分反应后,恰好完全反应生成NaB,B离子是弱离子,水解溶液呈碱性,离子浓度关系大小为:c(Na+)>c(B﹣)>c(OH﹣)>c(H+),故D错误;故选C。
=9,故C正确;D.等浓度等体积的HB与NaOH溶液充分反应后,恰好完全反应生成NaB,B离子是弱离子,水解溶液呈碱性,离子浓度关系大小为:c(Na+)>c(B﹣)>c(OH﹣)>c(H+),故D错误;故选C。

练习册系列答案
相关题目