题目内容
【题目】A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
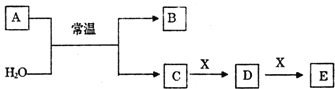
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:__________________。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则:
①组成单质A的元素在周期表中的位置为______________.
②X可能为__________(填代号)。
a.NaHCO3 b.Na2CO3 c.Na2SO3 d.Al(OH)3
(3)若A为淡黄色粉末,回答下列问题:
①1molA与足量的H2O充分反应时转移的电子数目为__________。
②A中所含有的化学键类型为___________________。
③若X为一种造成温室效应的气体.则鉴别等浓度的D、E两种溶液,可选择的试剂为__________(填代号)。
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式为______________,E是________________(填化学式)。
【答案】(1)OH﹣+HSO3﹣=SO32﹣+H2O
(2)①第三周期第VIIA族 ②bc
(3)①NA ②离子键、共价键 ③ab
(4)3NO2+H2O=2HNO3+NO Fe(NO3)2
【解析】(1)若A为常见的金属单质,焰色反应呈黄色,应为Na,X能使品红溶液褪色,应为SO2,则B为H2,C为NaOH,D为Na2SO3,E为NaHSO3,C和E反应的离子方程式为OH﹣+HSO3﹣=SO32﹣+H2O;
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,应为Cl2,则B为HClO,C为HCl。①Cl原子核外有3个电子层,最外层电子数为7,位于周期表第三周期ⅦA族;
②C为盐酸,可与NaHCO3反应生成CO2,但CO2与NaHCO3不反应,a错误;与Na2CO3反应生成CO2,CO2与Na2CO3反应可生成NaHCO3,b正确;与Na2SO3反应生成SO2,SO2与Na2SO3反应可生成NaHSO3,c正确;盐酸与氢氧化铝反应生成氯化铝,氯化铝与氢氧化铝不反应,d错误,答案选bc;
(3)若A为淡黄色粉末,应为Na2O2。①1molA与足量的H2O充分反应时过氧化钠自身发生氧化还原反应,转移的电子数目为NA;
②A为Na2O2,所含有的化学键类型为离子键、共价键;
③若X为一种造成温室效应的气体,应为CO2,则C为NaOH,D为Na2CO3,E为NaHCO3,鉴别等浓度的D、E两种溶液,可用盐酸或氯化钡溶液,答案选ab;
(4)若A为氧化物,X是Fe,由转化关系可知C具有强氧化性,则A为NO2,B为NO,C为HNO3,NO2与水反应的方程式为3NO2+H2O=2HNO3+NO;C为HNO3,硝酸与铁反应生成硝酸铁,硝酸铁与铁反应生成硝酸亚铁,E为硝酸亚铁,化学式为Fe(NO3)2。