题目内容
【题目】根据下列化合物:①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O,回答下列问题。
(1)NH4Cl溶液显 性,用离子方程式表示原因 ,其溶液中离子浓度大小顺序为 。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH)= ,在pH=3的CH3COOH溶液中,水电离出来的c(H+)= 。
(3)已知纯水中存在如下平衡:H2O+H2O![]() H3O++OH ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是 (填字母序号)。
H3O++OH ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是 (填字母序号)。
A.向水中加入NaHSO4固体
B.向水中加Na2CO3固体
C.加热至100 ℃[其中c(H+)=1106 mol·L1]
D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH和⑦NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m (填“<”“>”或“=”)n。
(5)除⑧H2O外,若其余7种物质的溶液中物质的量浓度相同,则这7种溶液按pH由大到小的顺序为 。
【答案】(13分,除标明外,每空2分)
(1)酸(1分) ![]() +H2O
+H2O![]() NH3·H2O+H+ c(Cl)>c(
NH3·H2O+H+ c(Cl)>c(![]() )>c(H+)>c(OH)
)>c(H+)>c(OH)
(2)1×103 mol·L1(1分) 1×1011 mol·L1(1分)
(3)D
(4)<
(5)②>⑦>⑤>①>④>⑥>③
【解析】(1)NH4Cl为强酸弱碱盐,由于![]() 水解,其溶液呈酸性,故其溶液中离子浓度的大小关系为c(Cl)>c(
水解,其溶液呈酸性,故其溶液中离子浓度的大小关系为c(Cl)>c(![]() )>c(H+)>c(OH)。
)>c(H+)>c(OH)。
(2)CH3COONa溶液中,由于醋酸根离子的水解促进了水的电离,故pH=11的CH3COONa溶液中,水电离出来的c(OH)=1×103 mol·L1;在pH=3的CH3COOH溶液中,水的电离受到抑制,故水电离出来的c(H+)=1×1011 mol·L1。
(3)A项使溶液呈酸性,但电离平衡向左移动;B项虽使平衡向右移动,但溶液呈碱性;C项操作虽使平衡向右移动,但水仍然呈中性;D项中由于![]() 的水解,促进水的电离而使溶液呈酸性。
的水解,促进水的电离而使溶液呈酸性。
(4)由于NH3·H2O是弱电解质,存在电离平衡,故m<n。
(5)判断方法:同浓度溶液pH值 强碱>弱碱>弱酸强碱盐>中性盐(NaCl)>强酸弱碱盐>弱酸>强酸。

【题目】Where will the woman go on Saturday?
A. To a restaurant.
B. To the dentist's.
C. To the man's home.
【题目】读我国北方某地区的部分资料,完成下列各题。
年份 | 森林覆盖率(%) | 耕地面积(KM2 ) | 年降水量(mm) | 气温年较差(℃) | 河流含沙量(%) | 粮食平均亩产(kg) | 粮食总产量(亿kg) |
1985 | 19 | 333 | 520 | 38 | 10 | 205 | 1.025 |
1995 | 10 | 478 | 450 | 42 | 35 | 135 | 0.975 |
(1)根据上表,结合所学的地理知识,把以下四项的代号填入下图中适当的空格,使之完成一个循环过程。
①土壤肥力下降 ②暴雨增多 ③进一步毁林开荒 ④洪水灾害增多
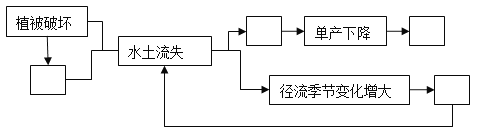
(2)据上表和框图,分析该地耕地面积扩大,而粮食总产量却降低的原因。
(3)目前我国粮食安全问题不容乐观,应采取什么措施保障粮食安全?
(4)目前,该地区生态环境的主要问题是 。(单项选择题)
A.水土流失严重 B.风沙危害严重
C.大陆性气候减弱 D.光照条件变差
【题目】读表,完成下列要求。
2010年和2014年北京市常住人口变化(单位:万人)
年份 | 2010年 | 2014年 | |
常住人口总数 | 1961.2 | 2151.6 | |
其中 | 户籍人口 | 1256.7 | 1332.9 |
外来常住人口 | 704.5 | 818.7 | |
(1)表中数据显示,北京市常住人口增长主要来自 增长。
2010年人口普查显示,朝阳区和海淀区的常住外来人口超过百万,昌平区排在第三位,形成多个外来人口聚集区——“城中村”,如图所示。

(2)“城中村”一般具有交通便利,租金低廉的特点,但由于人口高度集中容易出现 , 等城市问题。
(3)北京市提出2020年人口控制在2300万以下的目标,主要是考虑北京市的 和 条件,尤其是 资源的承载能力。
(4)在控制人口的同时,北京市为实现可持续发展还应采取的措施是 (选择填空)。
A.实施南水北调——提高地域开放程度
B.加强污水处理——提高资源的利用率
C.更多开辟农田——提高居民消费水平
D.大力发展工业——提高经济发展水平