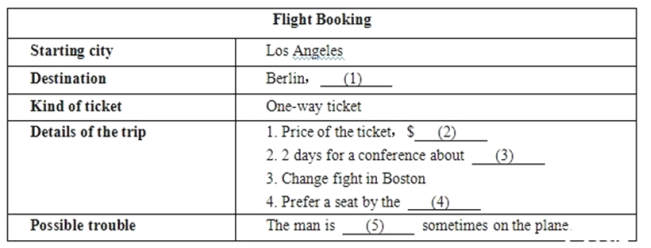
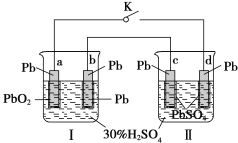
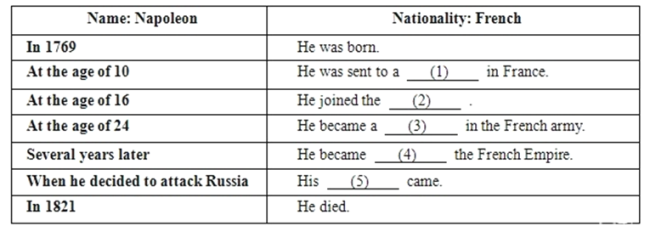
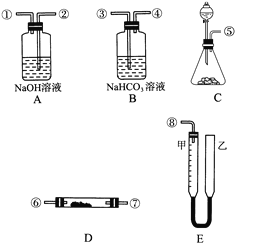
题目内容
【题目】将1 mol CH4和适量O2在密闭容器中混合点燃,充分反应后,CH4和O2均无剩余,且产物均为气体,质量为72 g,下列叙述正确的是( )
A.若将产物通过碱石灰,则可全部被吸收;若通入浓硫酸,则不能完全被吸收
B.产物的平均摩尔质量为20 g·mol-1
C.若将产物通过浓硫酸后恢复至室温,压强变为反应前的![]()
D.反应中消耗O256 g
【答案】D
【解析】根据质量守恒定律可知,m(O2)=72 g-16 g=56 g,D项正确;n(O2)=![]() =1.75 mol,由CH4+2O2
=1.75 mol,由CH4+2O2![]() CO2+2H2O可知,若产物均为CO2和H2O,则消耗2 mol O2,故反应生成的产物应有CO,CO既不能被碱石灰吸收,也不能被浓硫酸吸收,故A项错误;由H原子守恒可知,反应生成的n(H2O)=2 mol,m(H2O)=36 g,由C原子守恒可知,CO和CO2混合气体的物质的量等于CH4的物质的量,即为1 mol,则混合气体的总物质的量为1 mol+2 mol=3 mol,产物的平均摩尔质量为
CO2+2H2O可知,若产物均为CO2和H2O,则消耗2 mol O2,故反应生成的产物应有CO,CO既不能被碱石灰吸收,也不能被浓硫酸吸收,故A项错误;由H原子守恒可知,反应生成的n(H2O)=2 mol,m(H2O)=36 g,由C原子守恒可知,CO和CO2混合气体的物质的量等于CH4的物质的量,即为1 mol,则混合气体的总物质的量为1 mol+2 mol=3 mol,产物的平均摩尔质量为![]() =24 g·mol-1,B项错误。产物通过浓硫酸后恢复至室温,剩余气体是CO和CO2的混合气体。物质的量为1 mol,而反应前气体的总物质的量为1 mol+1.75 mol=2.75 mol,C项错误。
=24 g·mol-1,B项错误。产物通过浓硫酸后恢复至室温,剩余气体是CO和CO2的混合气体。物质的量为1 mol,而反应前气体的总物质的量为1 mol+1.75 mol=2.75 mol,C项错误。

【题目】实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:
实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
实验设计如下表:
实验步骤 | 实验结论 |
①新制氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
②NaBr溶液+新制氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
③KI溶液+新制氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
请回答下列问题:
(1)完成该实验需用到的实验仪器是 、 。(填仪器名称)
(2)步骤②中反应的化学方程式为 ,步骤③中反应的离子方程式为 。
(3)CCl4在实验中所起的作用是 。
(4)该同学的实验设计不足之处是 ,改进的办法是 。