题目内容
【题目】【百强校·2016届兴义市第八中学兴趣第五次月考】中国沿海某城市采用反渗透法将海水淡化,得到淡水供市民使用,剩余母液继续加工获得其他产品。母液中主要含有Cl-、Na+、K+、Ca2+、SO42-、Br-等离子。某实验小组同学模拟工业生产流程,进行如下实验.
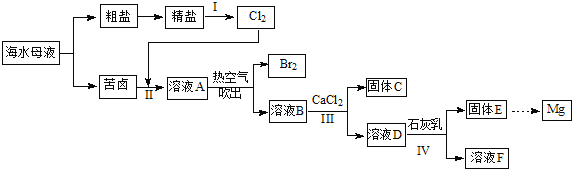
(1)写出实验室制备氯气的化学方程式_____________________;
(2)海水淡化的方法还有____________(写出一种);
(3)I中,电解饱和食盐水的工业生产叫做氯碱工业,写出该反应的离子方程式__________;
(4)Cl2和Br2均为双原子分子,从原子结构的角度解释其原因_____________________;
(5)Ⅲ中,加入适量CaCl2固体的目的是_____________________;
(6)写出IV中反应的离子方程式_____________________;
(7)与过程II类似,工业上常用“空气吹出法”实现海水提溴,将1m3海水浓缩至1L,使用该法最终得到36g Br2,若提取率为60%,则原海水中溴的浓度为__________ mg/L。
【答案】(1)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O(2)蒸馏法(或电渗析法、离子交换法)
MnCl2+Cl2↑+2H2O(2)蒸馏法(或电渗析法、离子交换法)
(3)2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑(4)氯、溴元素位于同一主族,最外层均为7e-,两个原子各提供1e-,形成共用电子对,两个原子都形成了8e-稳定结构(5)除去SO42-
2OH-+Cl2↑+H2↑(4)氯、溴元素位于同一主族,最外层均为7e-,两个原子各提供1e-,形成共用电子对,两个原子都形成了8e-稳定结构(5)除去SO42-
(6)Mg2++Ca(OH)2═Mg(OH)2↓+Ca2+(7)60
【解析】(1)实验室利用二氧化锰与浓盐酸反应制备氯气,反应的化学方程式MnO2+4HCl(浓) 最常用的是蒸馏法;(3)电解饱和食盐水生成氯化钠、氯气、氢气,反应的离子方程式为2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑;(4)由于氯、溴元素位于同一主族,最外层均为均为7e-,两个原子各提供1e-,形成共用电子对,两个原子都形成了8e-稳定结构,所以Cl2和Br2均为双原子分子(5)硫酸根离子能够与钙离子反应生成硫酸钙沉淀,所以加入氯化钙溶液的目的是除去SO42- (6)氢氧化镁更难溶,IV镁离子与氢氧化钙反应生成氢氧化镁沉淀和钙离子,该反应的离子方程式为Mg2++Ca(OH)2═Mg(OH)2↓+Ca2+(7)将1m3海水浓缩至1L,使用该法最终得到36g Br2,若提取率为60%,则1m3海水中溴元素的质量为36g/60%=60g。则该海水中溴元素的浓度为60g/1×103L=60 mg/L
2OH-+Cl2↑+H2↑;(4)由于氯、溴元素位于同一主族,最外层均为均为7e-,两个原子各提供1e-,形成共用电子对,两个原子都形成了8e-稳定结构,所以Cl2和Br2均为双原子分子(5)硫酸根离子能够与钙离子反应生成硫酸钙沉淀,所以加入氯化钙溶液的目的是除去SO42- (6)氢氧化镁更难溶,IV镁离子与氢氧化钙反应生成氢氧化镁沉淀和钙离子,该反应的离子方程式为Mg2++Ca(OH)2═Mg(OH)2↓+Ca2+(7)将1m3海水浓缩至1L,使用该法最终得到36g Br2,若提取率为60%,则1m3海水中溴元素的质量为36g/60%=60g。则该海水中溴元素的浓度为60g/1×103L=60 mg/L