题目内容
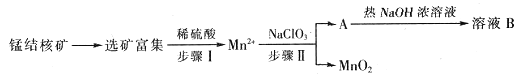
【题目】MnO2是一种重要的无机功能材料,工业上从锰结核矿中制取纯净的MnO2的工艺流程如图所示:
部分难溶的电解质溶度积常数(Ksp)如下表:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 1017 | 1017 | 1039 |
已知:一定条件下,![]() 可与Mn2+反应生成MnO2。
可与Mn2+反应生成MnO2。
(1)步骤Ⅱ中消耗0.5 mol Mn2+时,用去1 mol·L1的NaClO3溶液200 mL,该反应离子方程式为__________________________________。
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是_____________。
(3)MnO2是碱性锌锰电池的正极材料。放电过程产生MnOOH,该电池正极的电极反应式为_________________。如果维持电流强度为5 A,电池工作五分钟,理论消耗锌_________________g。(精确到0.1,已知F=96500 C/mol)
(4)向废旧锌锰电池内的混合物[主要成分MnOOH、Zn(OH)2]中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的离子方程式:_____________________。向所得溶液中滴加高锰酸钾溶液产生黑色沉淀,设计实验证明黑色沉淀成分为MnO2。_________________________________。
(5)用废电池的锌皮制作ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为________(精确到0.1)时,铁刚好沉淀完全(离子浓度小于1×105 mol·L1时,即可认为该离子沉淀完全)。继续加碱调节pH为__________时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L1)。
【答案】(15分,除标明外,每空2分)
(1)5Mn2++ 2![]() +4H2O
+4H2O![]() 5 MnO2+Cl2↑ +8H+
5 MnO2+Cl2↑ +8H+
(2)氯酸钠(1分)
(3)MnO2+ H2O +e![]() MnOOH +OH 0.5
MnOOH +OH 0.5
(4)2MnOOH+ H2C2O4 +4H+ ![]() 2Mn2++ 2CO2↑+4H2O
2Mn2++ 2CO2↑+4H2O
取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固体为MnO2
(5)2.7 6
【解析】本题考查化学工艺流程。(1)步骤Ⅱ中消耗0.5 mol Mn2+时,用去1 mol·L1的NaClO3溶液
200 mL,NaClO3的物质的量为0.2 mol,Mn2+与NaClO3的系数比5∶2,根据电子守恒、电荷守恒、原子守恒,可写出该反应离子方程式为5Mn2++ 2![]() +4H2O
+4H2O![]() 5 MnO2+Cl2↑ +8H+。
5 MnO2+Cl2↑ +8H+。
(2)Cl2与 NaOH在加热的情况下发生的反应是:3Cl2+6NaOH![]() NaClO3+5NaCl+3H2O,NaClO3是可循环用于上述生产的。
NaClO3+5NaCl+3H2O,NaClO3是可循环用于上述生产的。
(3)正极MnO2得到电子产生MnOOH,电极反应式是MnO2+ H2O +e![]() MnOOH +OH,如果维持电流强度为5A,电池工作五分钟,消耗Zn的质量,根据公式列式:Q=It=5 A×5×60 s=
MnOOH +OH,如果维持电流强度为5A,电池工作五分钟,消耗Zn的质量,根据公式列式:Q=It=5 A×5×60 s=
![]() =0.5g。
=0.5g。
(4)MnOOH与H2C2O4之间的反应,产物有CO2,则反应的离子方程式为:2MnOOH+ H2C2O4+4H+![]() 2Mn2++2CO2↑+4H2O。证明黑色沉淀成分为MnO2则让其与浓盐酸混合并加热, 产生黄绿色气体Cl2,从而进行检验。
2Mn2++2CO2↑+4H2O。证明黑色沉淀成分为MnO2则让其与浓盐酸混合并加热, 产生黄绿色气体Cl2,从而进行检验。
(5)Ksp(Fe(OH)3)=1039=c3(OH)·c(Fe 3+),c3(OH)=1039/105=1034,c(OH)=![]() ,c(OH)·c(H+)=1014,pH=2.7。Ksp(Zn(OH)2)=1017= c2(OH)·c(Zn 2+),c2(OH)=1017/0.1=1016,c (OH)=108,c (H+)=106,pH=6。
,c(OH)·c(H+)=1014,pH=2.7。Ksp(Zn(OH)2)=1017= c2(OH)·c(Zn 2+),c2(OH)=1017/0.1=1016,c (OH)=108,c (H+)=106,pH=6。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案