题目内容
【题目】【2017·大连模拟】向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式:________________________________。
(2)下列三种情况下,离子方程式与(1)相同的是______(填字母)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
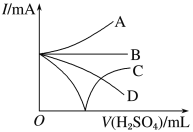
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用下图中的________曲线表示(填字母)。
(4)若向装有Ba(OH)2溶液的烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应。则反应的离子方程式是______________________。
【答案】(1)Ba2++2OH-+SO42-+2H+===BaSO4↓+2H2O (2)A (3)C
(4)2Ba2++4OH-+Al3++2SO42-===2BaSO4↓+AlO2-+2H2O
【解析】 (1)Ba(OH)2溶液中逐滴加入稀硫酸生成水和硫酸钡沉淀,离子反应为Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O。
(2)A的离子反应是Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O,B、C的离子反应是Ba2++OH-+H++SO42-===BaSO4↓+H2O,选A。
(3)随着H2SO4的加入至二者刚好反应时,溶液的导电能力逐渐减弱至不导电,随后硫酸过量,溶液的导电能力逐渐增强,选C。
(4)若向装有Ba(OH)2溶液的烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应,此时二者物质的
量比为2∶1,则OH-与Al3+的物质的量比为4∶1,Al3+全部变为AlO2-,即:2Ba2++4OH-+Al3++2SO42-===2BaSO4↓+AlO2-+2H2O。