题目内容
【题目】【2015高考海南】氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程表示):0.1molL﹣1的氨水中加入少量NH4Cl固体,溶液的pH (填“升高”或“降低”);若加入少量明矾,溶液中NH4+的浓度 (填“增大”或“减小”).
(2)硝酸铵加热分解可得到N2O和H2O.250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol.
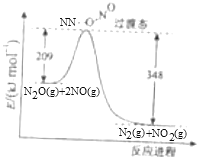
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,其△H=
kJmol﹣1.
【答案】(1) NH3H2O![]() NH4++OH﹣ 降低 增大
NH4++OH﹣ 降低 增大
(2)NH4NO3![]() N2O+2H2O K=c(N2O)×c2(H2O) 4 (3)-139
N2O+2H2O K=c(N2O)×c2(H2O) 4 (3)-139
【解析】(1)一水合氨为弱碱,在水溶液中存在部分电离,电离出氢氧根离子使溶液显碱性,方程式为:NH3H2O![]() NH4++OH﹣,向氨水中加入少量NH4Cl固体,铵根浓度增大,平衡左移,即氢氧根浓度减小,pH值降低,加入少量明矾,明矾电离出的铝离子结合氢氧根生成氢氧化铝,促进氨水的电离,铵根浓度增大;
NH4++OH﹣,向氨水中加入少量NH4Cl固体,铵根浓度增大,平衡左移,即氢氧根浓度减小,pH值降低,加入少量明矾,明矾电离出的铝离子结合氢氧根生成氢氧化铝,促进氨水的电离,铵根浓度增大;
(2)硝酸铵分解生成N2O和H2O,达到平衡,说明为可逆反应,化学反应方程式为:NH4NO3![]() N2O+2H2O,250℃时,水为气体状态,故平衡常数K=c(N2O)×c2(H2O),NH4NO3中NH4+的N元素化合价为﹣3价,NO3﹣中的N元素的化合价为+5价,反应后N元素的化合价为+1价,发生归中反应,N元素由﹣3价升高为+1价,此反应中每分解1mol硝酸铵,转移电子数为4mol;
N2O+2H2O,250℃时,水为气体状态,故平衡常数K=c(N2O)×c2(H2O),NH4NO3中NH4+的N元素化合价为﹣3价,NO3﹣中的N元素的化合价为+5价,反应后N元素的化合价为+1价,发生归中反应,N元素由﹣3价升高为+1价,此反应中每分解1mol硝酸铵,转移电子数为4mol;
(3)由图可知,此反应反应物总能量高于生成物,且△H=209﹣348=﹣139kJmol﹣1。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案