题目内容
【题目】二氯化砜(SO2Cl2)是一种无色液体,主要用于有机物和无机物的氯化等。其熔点为54.1 ℃,沸点为69.2 ℃;常温下比较稳定,受热易分解,遇水剧烈反应生成硫酸和盐酸。
(1)制备。实验室可利用SO2和Cl2按下列装置制取少量SO2Cl2(丙中放有樟脑液,起催化作用)。已知SO2(g)+Cl2(g)![]() SO2Cl2(g) △H<0。
SO2Cl2(g) △H<0。
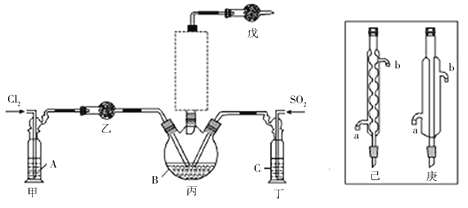
①可以用浓盐酸和酸性高锰酸钾制取氯气,该反应的化学方程式为________;溶液A为____。
②上图实框中仪器己的名称为___________;反应装置图的虚框中未画出的仪器是___________(填“己”或“庚”)。
③如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是_____________________。
④下列有关说法错误的是___________(填编号)。
a.乙、戊装置相同,在实验中的作用也完全相同
b.甲、丁装置为洗气装置,可用于气体的除杂和干燥
c.组装仪器后首先要进行的操作是检查装置的气密性
d.为提高反应物的利用率,可控制甲、丁装置中产生气泡的速率相等
(2)提纯。将收集到的产物进行减压蒸馏,减压蒸馏的目的是______________________。
(3)测定。取1.00 g蒸馏后液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.60 g,则所得蒸馏成分中二氯化砜的质量百分含量为___________%(精确到0.01)。
(4)贮存。二氯化砜应储存于阴凉、干燥、通风良好的库房。但久置后微显黄色,其原因是___________。
【答案】16HCl(浓)+2KMnO45Cl2↑+2MnCl2+2KCl+8H2O饱和氯化钠溶液球形冷凝管己该反应是放热反应,降低温度能使平衡向右移动,有利于二氯化砜的生成a降低二氯化砜的沸点,减少二氯化砜的分解92.70二氯化砜自身分解生成的氯气溶于二氯化砜中
【解析】(1)①利用高锰酸钾的氧化性强于氯气,因此反应方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;新制的氯气中混有HCl和水蒸气,而SO2Cl2遇水剧烈反应,因此杂质必须除去,除去氯气中的HCl常通过饱和食盐水,然后在通过浓硫酸或无水CaCl2,进行干燥,因此A为饱和食盐水;②己为球形冷凝管,球形冷凝管中气体遇冷却水的接触面积大,冷却效果好,便于原料或产物回落到三颈烧瓶中,因此选用球形冷凝管;③根据生成SO2Cl2的反应方程式,此反应是放热反应,依据勒夏特列原理,降低温度,促使平衡向正反应方向进行,有利于SO2Cl2的生成,同时防止SO2Cl2受热分解;④a、根据①的分析,乙装置的作用是除去氯气中的水蒸气,Cl2和SO2有毒,对环境有危害,因此必须尾气处理,因此戊的作用是吸收Cl2和SO2,防止污染环境,故说法错误;b、根据①的分析,甲装置除去氯气中HCl,因为SO2Cl2遇水发生反应,因此SO2需要干燥,丁装置的作用是干燥SO2,故说法正确;c、此反应有气体参加,需要检验装置的气密性,故说法正确;d、根据反应方程式,SO2和Cl2物质的量之比为1:1,为了节省原料,达到最大利用,SO2和Cl2的通入的速率相等,故说法正确;(2)沸点和压强有关,压强越大,沸点越高,SO2Cl2受热易分解,因此减压蒸馏降低SO2Cl2的沸点,减少SO2Cl2的分解;(3)SO2Cl2+2H2O=H2SO4+2HCl、H2SO4+BaCl2=BaSO4↓+2HCl,根据硫元素守恒,SO2Cl2~BaSO4,SO2Cl2质量1.6×135/233g=0.9270g,因此质量分数为92.70%;(4)二氯化砜自身分解生成的氯气溶于二氯化砜中。