题目内容
【题目】碱式碳酸铜可用于有机催化剂、杀虫剂及饲料中铜的添加剂,还可用于烟火和颜料制造。CuSO4溶液与Na2CO3溶液反应能否得到碱式碳酸铜?某班同学进行相关探究。
【沉淀制备】
称取12.5 g胆矾溶于87.4 mL蒸馏水中,滴4滴稀硫酸,充分搅拌后得到CuSO4溶液。向其中加入适量Na2CO3溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
(1)滴加稀硫酸的作用是 。所得硫酸铜溶液的溶质质量分数为 。
(2)用无水乙醇洗涤的目的是 。
【实验探究】
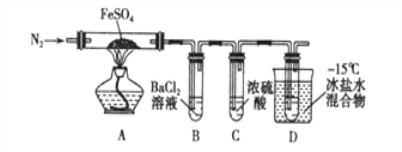
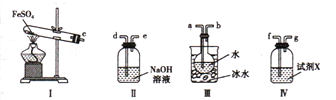
同学们设计了如下装置,用制得的蓝绿色固体进行实验:

(3)D装置加热前,需要首先打开活塞K,用A装置制取适量N2,然后关闭K,点燃D处酒精灯。A中产生N2的作用是 ,C中盛装的试剂应是 。
(4)装置A中发生反应的离子方程式为 。
(5)若蓝绿色固体的组成为xCuCO3·yCu(OH)2,实验能观察到的现象是 。
(6)同学们查阅文献知:Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,经讨论认为需要用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式,其原因是 。
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是 。若定量分析所取蓝绿色固体质量为27.1 g,装置F中使用Ba(OH)2溶液,实验结束后,装置E的质量增加2.7 g,F中产生沉淀19.7 g。则该蓝绿色固体的化学式为 。
【答案】(1)抑制Cu2+水解,防止溶液变浑浊(1分) 8.0%(1分)
(2)利用乙醇易挥发的性质带走沉淀上面的水(1分)
(3)排除装置中的空气,避免干扰(1分) 浓硫酸(1分)
(4)NO2-+NH4+![]() N2↑+2H2O(2分)
N2↑+2H2O(2分)
(5)硬质玻璃管中蓝绿色固体变黑色,E中白色固体变蓝,F中溶液变浑浊(2分)
(6)b d(2分) 让停留在装置中的气体被充分吸收,减小实验误差(1分)
2CuCO33Cu(OH)2或3Cu(OH)22CuCO3或Cu5(OH)6(CO3)2(2分)
【解析】(1)铜离子水解,因此滴加稀硫酸的作用是抑制Cu2+水解,防止溶液变浑浊。所得硫酸铜溶液的溶质质量分数为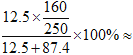 8.0%。
8.0%。
(2)乙醇和水互溶,易挥发,所以用无水乙醇洗涤的目的是利用乙醇易挥发的性质带走沉淀上面的水。(3)装置内有残留的空气,所以A中产生N2的作用是排除装置中的空气,避免干扰;生成的氮气中含有水蒸气,会干扰后续实验,所以C中盛装的试剂应是浓硫酸,除去氮气中的水蒸气。
(4)装置A中发生反应的离子方程式为NO2-+NH4+![]() N2↑+2H2O。
N2↑+2H2O。
(5)若蓝绿色固体的组成为xCuCO3·yCu(OH)2,因此受热分解生成氧化铜、CO2和水蒸气,则实验能观察到的现象是硬质玻璃管中蓝绿色固体变黑色,E中白色固体变蓝,F中溶液变浑浊。
(6)由于Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2,吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小,所以需要用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式。待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是让停留在装置中的气体被充分吸收,减小实验误差。若定量分析所取蓝绿色固体质量为27.1 g,装置F中使用Ba(OH)2溶液,实验结束后,装置E的质量增加2.7 g,即水蒸气是2.7g,物质的量是0.15mol。F中产生沉淀19.7 g,即碳酸钡是19.7g,物质的量是0.1mol,因此x:y=2:3,则该蓝绿色固体的化学式为2CuCO33Cu(OH)2。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案