题目内容
【题目】【2017·哈尔滨模拟】利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:
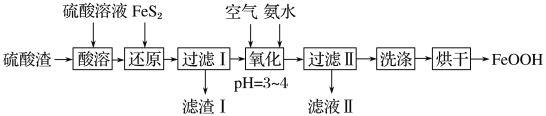
(1)“酸溶”时,Fe2O3与硫酸反应的化学方程式为___________________________。
(2)滤渣Ⅰ的主要成分是FeS2、S和________(填化学式);Fe3+被FeS2还原的离子方程式为_____________________________________________________________。
(3)“氧化”中,生成FeOOH的离子方程式为_________________________________。
(4)滤液Ⅱ中溶质是Al2(SO4)3和________(填化学式);“洗涤”时,检验铁黄表面已洗涤干净的操作是__________________。
【答案】(1)Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
(2)SiO2 2Fe3++FeS2===3Fe2++2S
(3)4Fe2++8NH3·H2O+O2===4FeOOH↓+8NH![]() +2H2O
+2H2O
(4)(NH4)2SO4 取最后一次洗涤液,滴加盐酸酸化的BaCl2溶液,若无白色沉淀,说明已洗干净
【解析】 (2)硫酸渣加硫酸酸溶,得Fe3+、Fe2+、Al3+的溶液,加FeS2还原Fe3+,SiO2不溶于酸,滤渣Ⅰ中还有SiO2。反应物为Fe3+、FeS2(硫显-1价,铁显+2价),生成物有Fe2+(Fe3+被还原为Fe2+)、S(滤渣Ⅰ成分之一),根据得失电子守恒配平。(3)滤液Ⅰ中主要含Fe2+、Al3+,加空气氧化Fe2+为Fe3+,加氨水调节pH 3~4,沉淀Fe3+。反应物为Fe2+、O2、NH3·H2O,生成物有FeOOH、NH![]() ,根据电子守恒有:4Fe2++NH3·H2O+O2―→4FeOOH↓+NH
,根据电子守恒有:4Fe2++NH3·H2O+O2―→4FeOOH↓+NH![]() ,根据电荷守恒配NH
,根据电荷守恒配NH![]() :4Fe2++8NH3·H2O+O2―→4FeOOH↓+8NH
:4Fe2++8NH3·H2O+O2―→4FeOOH↓+8NH![]() ,根据原子守恒补水。(4)由(3)中反应可判断滤液Ⅱ中溶质为Al2(SO4)3、(NH4)2SO4。由滤液Ⅱ成分可知铁黄表面可溶性杂质是Al2(SO4)3、(NH4)2SO4,若洗涤干净,则洗涤液中无SO
,根据原子守恒补水。(4)由(3)中反应可判断滤液Ⅱ中溶质为Al2(SO4)3、(NH4)2SO4。由滤液Ⅱ成分可知铁黄表面可溶性杂质是Al2(SO4)3、(NH4)2SO4,若洗涤干净,则洗涤液中无SO![]() 。
。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案