题目内容
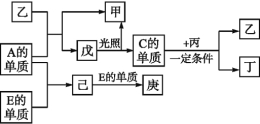
【题目】A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子序数按B、D、C、A、E的顺序依次增大,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合可得丁,戊、己、庚均为化合物。已知乙、丙每个分子中均含有10个电子,下图为相互转化关系。
请回答下列问题:
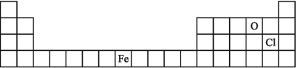
(1)下面是元素周期表的一部分,请将A、C、E用元素符号填在相应的位置上。

(2)写出实验室制取A的单质的离子反应方程式: 。
(3)戊的分子式为 。B与D形成的原子个数比为2∶1的化合物中,D原子最外层为8电子结构,请写出该化合物的化学式: 。
(4)A的单质与丙常温下发生反应生成甲与D的单质,该反应的化学方程式为 。
(5)8 g E的单质在A的单质中充分燃烧放出热量Q kJ,写出该反应的热化学方程式: (热量是在常温下测定的)。
(6)实验室配制庚溶液的实验方法是 。
【答案】(13分)
(1)(3分)
(2)MnO2+4H++2Cl![]() Mn2++Cl2↑+2H2O(2分)
Mn2++Cl2↑+2H2O(2分)
(3)HClO(1分) N2H4(1分)
(4)3Cl2+2NH3![]() N2+6HCl(2分)
N2+6HCl(2分)
(5)2Fe(s)+3Cl2(g)![]() 2FeCl3(s) ΔH=14Q kJ·mol1(2分)
2FeCl3(s) ΔH=14Q kJ·mol1(2分)
(6)向盐酸中加入适量的FeCl2晶体,搅拌溶解,然后加水稀释,并加入少许铁粉(2分)
【解析】本题主要考查了元素周期表与元素周期律等知识,意在考查学生综合分析问题的能力。由B的单质可以分别和C、D的单质化合形成10电子分子知B是氢元素,结合五种元素原子序数关系可知C、D可能是N、C或O、N或F、O,乙、丙可能是NH3、CH4或H2O、NH3或HF、H2O。结合框图转化关系中A的单质与乙反应的产物戊光照分解的情况知A是氯元素、乙是H2O、甲是HCl、戊是HClO,C是氧元素。则D是氮元素,丙是NH3,丁是NO,E是铁元素,己是FeCl3,庚是FeCl2。
(2)实验室通常用浓盐酸与MnO2在加热条件下反应来制备氯气。
(3)D是氮元素,则相应的化合物是N2H4。
(4)氯气与NH3发生置换反应生成HCl与N2。
(5)根据题意可知1 mol铁在Cl2中充分燃烧生成FeCl3放出的热量为7Q kJ,据此可写出热化学方程式。
(6)实验室配制FeCl2溶液的实验方法向盐酸中加入适量的FeCl2晶体,搅拌溶解,然后加水稀释,并加入少许铁粉。